
可逆反應A(g)+3B(g) 2C(g) ΔH=-QkJ/mol。有甲、乙兩個容積相同且不變的密閉容器,向甲容器中加入1 mol A和3 mol B,在一定條件下達到平衡時放出熱量為Q1kJ;在相同的條件下,向乙容器中加入2 mol C達到平衡后吸收熱量為Q2
kJ;已知Q1=3Q2。下列敘述不正確的是( )
2C(g) ΔH=-QkJ/mol。有甲、乙兩個容積相同且不變的密閉容器,向甲容器中加入1 mol A和3 mol B,在一定條件下達到平衡時放出熱量為Q1kJ;在相同的條件下,向乙容器中加入2 mol C達到平衡后吸收熱量為Q2
kJ;已知Q1=3Q2。下列敘述不正確的是( )
A.甲中A的轉(zhuǎn)化率為75%
B.Q1+Q2=Q
C.達到平衡后,再向乙中加入0.25 mol A、0.75 mol B、1.5 mol C,平衡向正向移動
D.乙中的熱化學方程式為2C(g) A(g)+3B(g) ΔH= +Q2 kJ/mol
A(g)+3B(g) ΔH= +Q2 kJ/mol
D
【解析】
試題分析:兩者都會達到等效平衡。平衡時各物質(zhì)的濃度相等。甲從正反應方向開始達到平衡時放出的熱量與乙從逆反應方向開始達到平衡時吸收的熱量的和為QKJ。即Q1+Q2=Q。由Q1=3Q2可知:Q1=3/4QKJ,Q2=1/4QKJ.即有A1mol×3/4=0.75mol,的轉(zhuǎn)化, 轉(zhuǎn)化率為75%.此時個物質(zhì)的量為:A:0.25mol;B: 0.75mol;C:1.
5mol. 若達到平衡后,再向乙中加入0.25 mol A、0.75
mol B、1.5 mol C,平衡向正向移動。個物質(zhì)的濃度都是原來的2倍。相當于加壓。增大壓強,化學平衡向正反應方向移動。所以C正確。D.反應從正反應方向開始與反應從逆反應方向開始,能量變化數(shù)值相等,但放熱與吸熱正好相反。故乙中的熱化學方程式為2C(g) A(g)+3B(g) ΔH= +Q kJ/mol.錯誤。
A(g)+3B(g) ΔH= +Q kJ/mol.錯誤。
考點:考查等效小平衡及反應從正反應、逆反應兩個不同方向進行時各物質(zhì)的轉(zhuǎn)化率及含量問題的知識。


科目:高中化學 來源: 題型:
下圖為可逆反應A(g)+2B(g)nC(g) △H>0生成物C的濃度隨壓強變化并建立平衡的關系圖,則n值與壓強p1、p2的關系正確的是 ( )
A. p2>p1,n<3
B. p2>p1,n>3
C. p1>p2,n<3
D. p1>p2,n>3
查看答案和解析>>
科目:高中化學 來源: 題型:
(12分)有可逆反應A(g)+B(g) xC(g)+D(g),某溫度時,在固定容積為2L的密閉容器內(nèi)充入一定量的A、B,并保持溫度不變。A、B、C、D物質(zhì)的量隨時間的變化如圖所示:
(1)根據(jù)圖中所示,x=_______________;該反應的平衡狀態(tài)為圖中的____________min;
(2)0~5min的平均反應速率v(A)=_______________________________(用小數(shù)表示)。
(3)6min時改變影響平衡的一個條件,A、B、C、D的變化曲線如圖中6~8min所示,則平衡_________移動(填“向左”、“向右”或“不”),可能的原因是________(選填序號)。
a、增大A的物質(zhì)的量 b、加入催化劑
c、增加C的物質(zhì)的量 d、減小容器體積
(4)若反應一開始就加入了合適的催化劑,在圖中畫出氣體A在0~6min時的變化曲線。
查看答案和解析>>
科目:高中化學 來源:2015屆四川省資陽市高一下學期期末檢測化學試卷(解析版) 題型:選擇題
在一定條件下,對于密閉容器中進行的可逆反應A(g)+3B(g)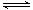
|
A.A、B、C的分子數(shù)之比為1∶3∶2
B.A、B、C的濃度相等
C.單位時間生成 n mol A,同時生成 3n mol B
D.生成C的速率與C分解的速率相等
查看答案和解析>>
科目:高中化學 來源:2015屆四川省高一下學期期中考試化學試卷(解析版) 題型:選擇題
在一定溫度下,可逆反應A(g)+3B(g) 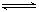 2C(g)達到平衡狀態(tài)的標志是
2C(g)達到平衡狀態(tài)的標志是
A. C生成的速率與A消耗的速率相等
B. 單位時間生成n mol A,同時生成3n mol B
C. A、B、C的濃度不再變化
D. v(A):v(B):v(C)=1∶3∶2
查看答案和解析>>
科目:高中化學 來源:2013屆陜西省高二上學期期中考試化學試卷(解析版) 題型:選擇題
右圖為可逆反應A(g)+2B(g) nC(g)
(正反應放熱)生成物C的濃度隨壓強變化并建立平衡的關系圖,則n值與壓強P1、P2的關系正確的是
nC(g)
(正反應放熱)生成物C的濃度隨壓強變化并建立平衡的關系圖,則n值與壓強P1、P2的關系正確的是

A. P2>P1,n<3 B. P2>P1,n>3
C. P1>P2,n<3 D.P1>P2,n>3
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com