
【題目】由幾種離子化合物組成的混合物,含有以下離子中的若干種:K+、NH4+、Mg2+、Cu2+、Ba2+、C1—、SO42—、CO32-。將該混合物溶于水后得無色澄清溶液,現分別取3份100mL該溶液進行如下實驗:
實驗序號 | 實驗內容 | 實驗結果 |
a | 加AgNO3溶液 | 有白色沉淀生成 |
b | 加足量NaOH溶液并加熱 | 收集到氣體1.12L(已折算成標準狀況下的體積) |
c | 加足量BaC12溶液時,對所得沉淀進行洗滌、干燥、稱量;再向沉淀中加足量稀鹽酸,然后干燥、稱量 | 第一次稱量讀數為6.27g,第二次稱量讀數為2.33g |
試回答下列問題:
(1)該混合物中一定不存在的離子是 。
(2)試寫出實驗b發生反應的離子方程式 。
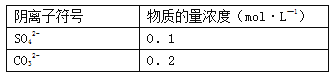
(3)溶液中一定存在的陰離子及其物質的量濃度(可不填滿):
陰離子符號 | 物質的量濃度(mol·L—1) |
(4)判斷混合物中是否存在K+,如果不存在,請說明理由,如果存在,請求出C(K+)的取值范圍? 。
(5)Ba2+是一種重金屬離子,某環境監測小組欲利用Na2S2O3、KI、K2Cr2O7等試劑測定某工廠廢水中Ba2+的濃度。取廢水50.00mL,控制適當的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀經洗滌、過濾后,用適量的稀鹽酸溶解,此時CrO42-全部轉化為Cr2O72-;再加過量KI溶液反應,反應液中再滴加0.100 mol·L-1Na2S2O3溶液,反應完全時,消耗Na2S2O3溶液36.00mL。已知有關的離子方程式為:
①Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O/span>;
②I2+2S2O32-=2I-+S4O62-。
試計算該工廠廢水中Ba2+的物質的量濃度。(寫出具體計算過程)
【答案】(1)Mg2+、Cu2+、Ba2+
(2)NH4+ +OH- =NH3 ↑+ H2O
(3)
(4)有,根據確定的離子的電荷守恒可知負電荷總數多余正電荷總數,求出C(K+)≥0.1mol/L。
(5)
x=(36.00×0.100×10-3mol)/3=1.2×10-3 mol
所以c(Ba2+)=1.2×10-3 mol ÷0.05L=0.024mol·L-1
【解析】
試題分析:根據題意,Ba2+和SO42-可發生離子反應生成BaSO4↓,因此兩者不能共存,Mg2+、Cu2+、Ba2+和CO32-可發生離子反應生成碳酸鎂、碳酸銅、碳酸鋇沉淀,因此也不能共存,將該混合物溶于水后得無色澄清溶液,這說明一定不存在銅離子。第一份加入AgNO3溶液有沉淀產生,可能發生Cl-+Ag+═AgCl↓、CO32-+2Ag+═Ag2CO3↓、SO42-+2Ag+═Ag2SO4↓,所以可能含有Cl-、CO32-、SO42-;第二份加足量NaOH溶液加熱后,收集到氣體0.05mol,和NaOH溶液加熱產生氣體的只能是NH4+,而沒有沉淀產生說明一定不存在Mg2+,故可確定一定含有NH4+,一定不存在Mg2+,根據反應NH4++OH-═NH3↑+H2O,產生NH3為0.05mol,可得NH4+也為0.05mol;第三份加足量BaCl2溶液后,得干燥沉淀6.27g,經足量鹽酸洗滌,干燥后,沉淀質量為2.33g,部分沉淀溶于鹽酸為BaCO3,部分沉淀不溶于鹽酸為BaSO4,發生反應CO32-+Ba2+═BaCO3↓、SO42-+Ba2+═BaSO4↓,因為BaCO3+2HCl═BaCl2+CO2↑+H2O而使BaCO3溶解.因此溶液中一定存在CO32-、SO42-,一定不存在Ba2+,由條件可知BaSO4為2.33g,物質的量為2.33g÷233g/mol=0.01mol,BaCO3為6.27g-2.33g═3.94g,物質的量為3.94g÷197g/mol=0.02mol,由上述分析可得,溶液中一定存在CO32-、SO42-、NH4+,而CO32-、SO42-、NH4+物質的量分別為0.02mol、0.01mol、0.04mol;一定不存在Mg2+、Cu2+、Ba2+;CO32-、SO42-所帶負電荷為0.02mol×2+0.01mol×2=0.06mol,NH4+所帶正電荷為0.05 mol,根據溶液中電荷守恒,可知K+一定存在,K+物質的量≥0.01 mol,當K+物質的量>0.01 mol時,溶液中還必須含有Cl-;當K+物質的量=0.01 mol時,溶液中不含有Cl-;
(1)根據以上分析可知該混合物中一定不存在的離子是Mg2+、Cu2+、Ba2+;
(2)實驗b發生反應的離子方程式NH4+ +OH- =NH3 ↑+ H2O;
(3)依據上述分析可知,溶液中一定存在的陰離子為CO32-、SO42-,SO42-物質的量為0.01mol,SO42-物質的量濃度=0.01mol÷0.1L=0.1mol/L,CO32-物質的量為0.02mol,CO32-物質的量濃度為0.02mol÷0.1L=0.2mol/L;
(4)根據以上分析可知K+一定存在,K+物質的量≥0.01mol,因此鉀離子濃度≥0.01mol/L。
(5)根據反應的方程式可知

x=(36.00×0.100×10-3mol)/3=1.2×10-3 mol
所以c(Ba2+)=1.2×10-3 mol ÷0.05L=0.024mol·L-1


科目:高中化學 來源: 題型:
【題目】某烴類化合物A的質譜圖表明其相對分子質量為84,紅外光譜表明分子中含有碳碳雙鍵,核磁共振氫譜表明分子中只有一種類型的氫原子。
(1)A的結構簡式為____________________________;
(2)A中的碳原子是否都處于同一平面?_________(填“是”或者 “否”);
(3)A是否存在順反異構體?_________(填“是”或者“否”)。
(4)用系統命名法命名A為______________________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物X是一種有機合成中間體,Z是常見的高分子化合物,某研究小組采用如下路線合成X和Z:
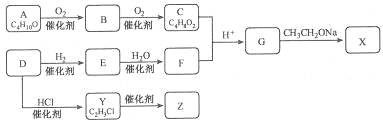
已知:①化合物A的結構中有2個甲基
②RCOOR′+R′′CH2COOR′![]()
![]()
請回答:
(1)寫出化合物E的結構簡式__________,F中官能團的名稱是_________。
(2)Y→Z的化學方程式是____________。
(3)G→X的化學方程式是__________,反應類型是___________。
(4)若C中混有B,請用化學方法檢驗B的存在(要求寫出操作、現象和結論)_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.分子式為C4H10O的醇,能在銅催化和加熱條件下被氧氣氧化為醛的同分異構體共有4種
B.2—氯丁烷與NaOH乙醇的溶液共熱的反應產物中一定不存在同分異構體
C.3—甲基—3—乙基戊烷的一氯代物有5種
D.分子式為C7H8O的有機物,能與氯化鐵溶液發生顯色反應的同分異構體共有3種
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學平衡原理在工農業生產中發揮著重要的指導作用。
(1) 反應C(s)+CO2(g)![]() 2CO(g)平衡常數K的表達式為 ;
2CO(g)平衡常數K的表達式為 ;
已知C(s) + H2O(g) ![]() CO(g)+H2(g)的平衡常數為K1;H2(g)+CO2(g)
CO(g)+H2(g)的平衡常數為K1;H2(g)+CO2(g) ![]() CO(g)+H2O(g)的平衡常數為K2 ,則K與K1、K2二者的關系為 。
CO(g)+H2O(g)的平衡常數為K2 ,則K與K1、K2二者的關系為 。
(2)已知某溫度下,反應2SO2+O2![]() 2SO3,的平衡常數K=19 mol·L-1。在該溫度下的體積固定的密閉容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,當反應在該溫度下SO2轉化率為80%時,該反應是否達到化學平衡狀態?計算過程和結論如下 :
2SO3,的平衡常數K=19 mol·L-1。在該溫度下的體積固定的密閉容器中充入c(SO2)=1mol·L-1,c(O2)=1 mol·L-1,當反應在該溫度下SO2轉化率為80%時,該反應是否達到化學平衡狀態?計算過程和結論如下 :
(3)若未達到,反應向 (填“正反應”或“逆反應”) 方向進行。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有資料認為NO、NO2不能與Na2O2反應。某小組學生提出質疑,從理論上分析Na2O2和NO2都有氧化性,根據化合價升降原則提出假設并進行探究:
假設Ⅰ.Na2O2能氧化NO2
假設Ⅱ.NO2能氧化Na2O2
(1)小組甲同學設計了如圖實驗裝置,并進行如下實驗:
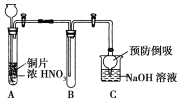
①試管A中發生反應的化學方程式是______________________________。
②待試管B中收集滿氣體,向試管B中加入適量Na2O2粉末,塞緊塞子,輕輕振蕩試管內粉末,觀察到紅棕色氣體迅速消失;再將帶余燼的木條迅速伸進試管內,看見木條復燃。甲同學認為假設Ⅱ正確;乙同學認為該裝置不能達到實驗目的,為達到實驗目的,在A、B之間增加一個裝置,該裝置的作用是______________________________。
③乙同學用改進后裝置,重復了甲同學的實驗操作,觀察到紅棕色氣體迅速消失;但帶余燼的木條未復燃。得出結論:假設Ⅰ正確。NO2和Na2O2反應的化學方程式是
_____________________________________________________________________。
(2)丙同學認為NO易被O2氧化,更易被Na2O2氧化。
查閱資料:①2NO+Na2O2===2NaNO2
②6NaNO2+3H2SO4===3Na2SO4+2HNO3+4NO↑+2H2O
③酸性條件下,NO或NO都能與MnO反應生成NO和Mn2+
丙同學用下圖所示裝置(部分夾持裝置略)探究NO與Na2O2的反應。
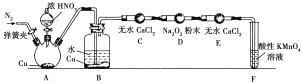
①A裝置中盛裝Cu片的儀器名稱是__________,B中觀察到的主要現象是______________________,F裝置的作用是______________________________。
②在反應前,打開彈簧夾,通入一段時間N2,目的是______________________________。
③充分反應后,檢驗D裝置中產物是NaNO2還是NaNO3的實驗方法是____________________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高溫下,某反應達平衡,平衡常數K=![]() 。恒容時,溫度升高,H2濃度減小。下列說法正確的是
。恒容時,溫度升高,H2濃度減小。下列說法正確的是
A、該反應的焓變為正值
B、恒溫恒容下,增大壓強,H2濃度一定減小
C、升高溫度,逆反應速率減小
D、該反應化學方程式為CO+H2O=CO2+H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】資源的高效利用對保護環境、促進經濟持續健康發展具有重要作用。磷尾礦主要含Ca5(PO4)3F和CaCO3·MgCO3。某研究小組提出了磷尾礦綜合利用的研究方案,制備具有重要工業用途的CaCO3、Mg(OH)2、P4和H2,其簡化流程如下:

已知:①Ca5(PO4)3F在950℃不分解;
②4Ca5(PO4)3F+18SiO2+30C![]() 2CaF2+30CO+18CaSiO3+3P4
2CaF2+30CO+18CaSiO3+3P4
請回答下列問題:
(1)950℃煅燒磷尾礦生成氣體的主要成分是___________。
(2)實驗室過濾所需的玻璃儀器是_____________。
(3)NH4NO3溶液能從磷礦Ⅰ中浸取出Ca2+的原因是__________。
(4)在浸取液Ⅱ中通入NH3,發生反應的化學方程式是____________。
(5)工業上常用磷精礦[Ca5(PO4)3F]和硫酸反應制備磷酸。已知25℃,101kPa時:
CaO(s)+H2SO4(l)=CaSO4(s)+H2O(l) ΔH=-271kJ/mol
5 CaO(s)+3H3PO4(l)+HF(g)= Ca5(PO4)3F (s)+5H2O(l) ΔH=-937kJ/mol
則Ca5(PO4)3F和硫酸反應生成磷酸的熱化學方程式是_________________。
(6)在一定條件下CO(g)+H2O(g)![]() CO2(g)+H2(g),當CO與H2O(g)的起始物質的量之比為1:5,達平衡時,CO轉化了
CO2(g)+H2(g),當CO與H2O(g)的起始物質的量之比為1:5,達平衡時,CO轉化了![]() 。若a kg含Ca5(PO4)3F(相對分子質量為504)的質量分數為10%的磷尾礦,在上述過程中有b%的Ca5(PO4)3F轉化為P4,將產生的CO與H2O(g)按起始物質的量之比1:3混合,則相同條件下達平衡時能產生H2________kg。
。若a kg含Ca5(PO4)3F(相對分子質量為504)的質量分數為10%的磷尾礦,在上述過程中有b%的Ca5(PO4)3F轉化為P4,將產生的CO與H2O(g)按起始物質的量之比1:3混合,則相同條件下達平衡時能產生H2________kg。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com