
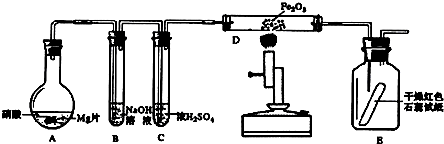
分析 NO2氣體與NaOH溶液反應的化學方程式為2NO2+2NaOH=NaNO3+NaNO2+H2O,NO與NaOH溶液不反應,但有NO2,發生反應NO2+NO+2NaOH=2NaNO2+H2O,A產生的氣體通入B中,在B中只生成一種鹽,剩余氣體遇空氣不變色,說明A產生的氣體中有NO和NO2兩種氣體且兩者的比例為1:1;結合(c)可知D中生成的氣體是NH3,同時有水生成,反推知由N2和H2合成,即進入D中的氣體為N2和H2,二者體積之比為1:1,二者體積之和等于NO和NO2兩種氣體的體積之和,故Mg和HNO3反應生成的氣體有NO、NO2、N2、H24種,且物質的量相等,據此解答.
解答 解:NO2氣體與NaOH溶液反應的化學方程式為2NO2+2NaOH=NaNO3+NaNO2+H2O,NO與NaOH溶液不反應,但有NO2,發生反應NO2+NO+2NaOH=2NaNO2+H2O,A產生的氣體通入B中,在B中只生成一種鹽,剩余氣體遇空氣不變色,說明A產生的氣體中有NO和NO2兩種氣體且兩者的比例為1:1;結合(c)可知D中生成的氣體是NH3,同時有水生成,反推知由N2和H2合成,即進入D中的氣體為N2和H2,二者體積之比為1:1,二者體積之和等于NO和NO2兩種氣體的體積之和,故Mg和HNO3反應生成的氣體有NO、NO2、N2、H24種,且物質的量相等,
(1)由上述分析可知,硝酸與Mg片反應生成的氣體成分是NO、NO2、N2、H2,
故答案為:NO、NO2、N2、H2;
(2)反應中硝酸中氮元素在產物中存在與硝酸鎂、硝酸銨、NO、NO2、N2中,N元素化合價表示為變化,部分解答,故反應中硝酸起酸性、氧化劑作用,
故答案為:酸性、氧化劑.
點評 本題以實驗形式考查無機物推斷,需要學生對信息進行利用,需要學生具有扎實的基礎與綜合運用能力,對學生的邏輯推理具有較高的要求,本題關鍵是確定每與硝酸反應的產物確定,難度很大,為易錯題目.


 開心快樂假期作業暑假作業西安出版社系列答案
開心快樂假期作業暑假作業西安出版社系列答案 名題訓練系列答案
名題訓練系列答案科目:高中化學 來源:2016-2017學年江西省高二上10月月考化學試卷(解析版) 題型:選擇題
已知下列兩個氣態物質之間的反應:
C2H2(g)+H2(g)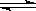 C2H4(g)①
C2H4(g)①
2CH4(g)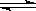 C2H4(g)+2H2(g)②
C2H4(g)+2H2(g)②
已知在降低溫度時①式平衡向右移動,②式平衡向左移動,則下列三個反應:
(Q1、Q2、Q3均為正值)
C(s)+2H2(g)=CH4(g)ΔH=-Q1
2C(s)+H2(g)=C2H2(g)ΔH=-Q2
2C(s)+2H2(g)=C2H4(g)ΔH=-Q3Q值大小比較正確的是( )
A. Q1>Q3>Q2 B. Q1>Q2>Q3 C. Q2>Q1>Q3 D. Q3>Q1>Q2
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖北省高二上月考一化學卷(解析版) 題型:實驗題
用50mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液在如圖所示的裝置中進行中和反應。通過測定反應過程中所放出的熱量可計算中和熱。回答下列問題:
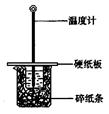
(1)從實驗裝置上看,圖中尚缺少的一種玻璃儀器是 。
(2)大燒杯上如不蓋硬紙板,求得的中和熱數值 (填“偏大、偏小、無影響”)
(3)如果用60mL0.50mol/L鹽酸與50mL0.55mol/LNaOH溶液進行反應,與上述實驗相比,所放出的熱量 (填“相等、不相等”),所求中和熱 (填“相等、不相等”),簡述理由
(4)用相同濃度和體積的氨水代替NaOH溶液進行上述實驗,測得的中和熱的數值會 (填“偏大”、“偏小”、“無影響”,下同) 若用KOH代替NaOH,測定結果會 __ __
(5)他們記錄的實驗數據如下:
實 驗 用 品 | 溶 液 溫 度 | 中和熱△H | |||
t1 | t2 | ||||
① | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.3℃ | |
② | 50mL0.55mol.L-1NaOH | 50mL.0.5mol.L-1HCl | 20℃ | 23.5℃ | |
已知反應后溶液的比熱容C為4.18KJ·℃-1· Kg-1,各物質的密度均為1g·cm-3。
①計算完成上表。
②根據實驗結果寫出NaOH溶液與HCl溶液反應的熱化學方程式: 。
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 水解反應 | 平衡常數(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
| 實驗內容 | 實驗現象 |
| 甲同學的實驗方案 | 溶液逐漸變成藍綠色,pH略有上升 |
| 乙同學的實驗方案 | 無明顯現象,pH沒有明顯變化. |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
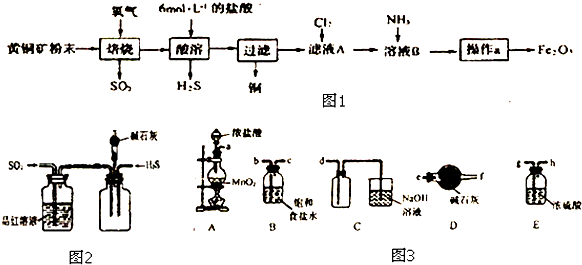
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| 選項 | 操作 | 現象 | 結論 |
| A | 將足量的乙烯通入到溴水中 | 溴水褪色 | 乙烯與溴水反應生成無色物質 |
| B | 往CaCl2溶液中通入足量的CO2 | 先有白色沉淀生成,后沉淀溶解 | CaCO3不溶于水,Ca(HCO3)2可溶于水 |
| C | 將銅板電路投入FeCl3溶液中 | 銅溶于FeCl3溶液 | 氧化性:Fe3+>Cu2+ |
| D | 取久置的Na2O2粉末,向其中滴加足量的鹽酸 | 產生無色氣體 | Na2O2已變質為Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
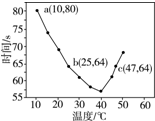
| A. | 40℃之前與40℃之后溶液變藍的時間隨溫度的變化趨勢相反 | |
| B. | 圖中b、c兩點對應的NaHSO3的反應速率相等 | |
| C. | 圖中a點對應的NaHSO3的反應速率為5.0×10-5 mol•(L•s)-1 | |
| D. | 溫度高于40℃時,淀粉不宜用作該實驗的指示劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 一定有甲烷 | B. | 一定有乙烷 | C. | 一定無甲烷 | D. | 可能有乙烯 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硝酸鈉和金剛石 | B. | 冰和干冰 | C. | 晶體硅和水晶 | D. | 萘和苯 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com