


 七彩題卡口算應用一點通系列答案
七彩題卡口算應用一點通系列答案科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| 常溫下 |
| SO2 |
| A、MFe2Ox是氧化劑 |
| B、x<y |
| C、SO2是該反應的催化劑 |
| D、SO2發生氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、① | B、②⑤ | C、①④ | D、①④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
| ||
| ||
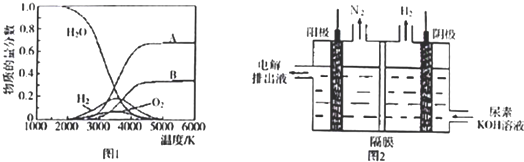
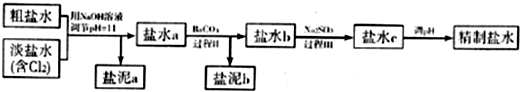
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、3mol NO2與量H2O 反應,轉移電子2mol |
| B、1 mol C5H12 分子中含有的共價鍵數目為17N A |
| C、濃度均為0.lmol/L CH3COONa、CH3COOH 混合溶液100mL 中所含CH3COO-、CH3COOH 的徽粒總數為0.02NA |
| D、標準狀況下11.2L 的CH4、CD4、CT4的混合氣體中含有的質子數為5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:
 近年來,化學工作者在CO2的應用研究上取得了一些重要成果.
近年來,化學工作者在CO2的應用研究上取得了一些重要成果.| 3 |
| 2 |
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:

| A、上述反應中涉及的氧化還原反應共有3個 |
| B、氧化性:Cl2>NaBi03>Bi205>Bi203? |
| C、生成NaBi03的反應中,NaBi03的化學計量數為2 |
| D、得到0.05molBi203時,上述過程中共轉移電子0.4 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com