
A、B、C、D、E是元素周期表中前36號元素,核電荷數依次增大,A與B能形成種類繁多的化合物,D原子中成對電子數等于未成對電子數的3倍;E+中所有電子正好充滿K、L、M三個電子層。
(1)基態C原子核外有_____種運動狀態不同的電子,元素C的氣態氫化物的空間構型為____。
(2)B、C、D三種元素的第一電離能由大到小的順序為_________。(用元素符號表示)
(3)A與B形成的化合物B2A2中B原子的雜化方式為____,分子中含有的σ鍵和π鍵個數分別是______、_______。
(4)D與鈉元素形成的原子數之比為l:1的物質中具有的化學鍵類型為______。
(5)E+與C的簡單離子形成晶體的晶胞結構如圖1所示,圖中白球表示_______。
(6)E的單質晶體的晶胞結構如圖2所示,其空間利用率為_____(圓周率用π表示,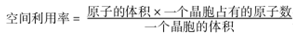 )
)
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源:2016-2017學年江蘇省揚州市寶應縣高二下學期學業水平測試(三)化學試卷(解析版) 題型:選擇題
我國首創的海洋電池以鋁板、鉑網為電極,以海水作為電解質溶液,電池總反應為:4Al+3O2+6H2O=4Al(OH)3,下列有關該電池說法正確的是
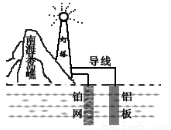
A. 該電池工作時將電能轉化為化學能
B. 通常一段時間后該電池只需更換鋁板就可繼續使用
C. 負極反應式是:O2 + 2H2O+ 4e- = 4OH-
D. 鋁片發生還原反應
查看答案和解析>>
科目:高中化學 來源:2016-2017學年黑龍江省哈爾濱市高二3月月考化學試卷(解析版) 題型:選擇題
實驗室用鋅粒與VmL濃度為10%的稀硫酸反應制取氫氣,若向反應混合物中加入下列物質,關于反應速率v說法正確的是
A. 少量Na2SO4固體,v(H2)減小 B. VmLBaCl2溶液,v(H2)不變
C. 加入細小的碳粒,v(H2)增大 D. 加入NH4HSO4固體,v(H2)不變
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河南省洛陽市高二(平行班)3月月考化學試卷(解析版) 題型:選擇題
下列描述中正確的是
A. ClO3-的空間構型為平面三角形
B. SiF4和 SO32-的中心原子均為 sp3雜化
C. 在所有的元素中,氟的第一電離能最大
D. C2H5OH 分子中共含有 8 個極性鍵,1 個 π 鍵
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河南省洛陽市高二(平行班)3月月考化學試卷(解析版) 題型:選擇題
短周期主族元素A、B、C、D、E的原子序數依次遞增,A、B兩元素相鄰,B、C、E原子的最外層電子數之和為13,E原子最外層電子數是B原子內層電子數的3倍,也是C原子最外層電子數的3倍,B、D原子最外層電子數之和等于C、E原子最外層電子數之和. 下列說法正確的是( )
A. 原子半徑C>D>E,三者形成的簡單離子中D離子的半徑最小
B. 元素A所形成的氫化物常溫下一定為氣態
C. 元素C、D、E在自然界中均不能以游離態存在
D. 元素B的氧化物對應的水化物一定為強酸
查看答案和解析>>
科目:高中化學 來源:2017屆陜西省西安市高三模擬(一)理綜化學試卷(解析版) 題型:選擇題
如右圖所示,甲池的總反應式為:N2H4+O2=N2+2H2O,下列關于該電池工作時的說法正確的是
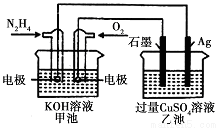
A. 該裝置工作時,Ag電極上有氣體生成
B. 甲池和乙池中的溶液的pH均減小
C. 甲池中負極反應為N2H4-4e-=N2+4H+
D. 當甲池中消耗0.1molN2H4時,乙池中理淪上最多產生6.4g固體
查看答案和解析>>
科目:高中化學 來源:2017屆天津市高三第四次月考化學試卷(解析版) 題型:實驗題
(17分)亞氯酸鈉(NaClO2)是重要漂白劑。探究小組開展如下實驗,回答下列問題:
實驗Ⅰ:制取NaClO2晶體按下圖裝置進行制取。
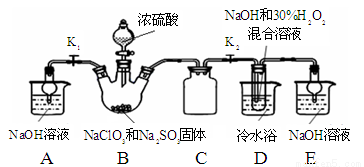
已知:NaClO2飽和溶液在低于38℃時析出NaClO2•3H2O,高于38℃時析出NaClO2,高于60℃時NaClO2分解成NaClO3和NaCl。
(1)用50%雙氧水配制30%的H2O2溶液,需要的玻璃儀器除玻璃棒、膠頭滴管、燒杯外,還需要 (填儀器名稱);
(2)裝置C的作用是 ;
(3)裝置B內生成的ClO2氣體與裝置D中混合溶液反應生成NaClO2,生成NaClO2的反應方程式為 。
(4)如果撤去D中的冷水浴,可能導致產品中混有的雜質是 ;
(5)反應后,經以下步驟可從裝置D的溶液獲得NaClO2晶體。請補充完整操作iii。
i.55℃蒸發結晶;
ii.趁熱過濾;
iii. ;
iv.低于60℃干燥,得到成品。
實驗Ⅱ:樣品雜質分析與純度測定
(6)上述實驗制得的NaClO2晶體中含少量Na2SO4。產生Na2SO4最可能的原因是 ;
a. B中有SO2氣體產生,并有部分進入D裝置內
b. B中濃硫酸揮發進入D中與NaOH中和
c. B中的硫酸鈉進入到D裝置內
(7)測定樣品中NaClO2的純度。測定時進行如下實驗:
準確稱一定質量的樣品,加入適量蒸餾水和過量的KI晶體,在酸性條件下發生如下反應:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-,將所得混合液稀釋成100mL待測溶液。取25.00mL待測溶液,加入淀粉溶液做指示劑,用c mol·L-1Na2S2O3標準液滴定至終點,測得消耗標準溶液體積的平均值為V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
①確認滴定終點的現象是 ;
②所稱取的樣品中NaClO2的物質的量為 (用含c、V的代數式表示)。
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省蘇州市高三上學期期末考試化學試卷(解析版) 題型:選擇題
下列根據實驗操作和現象所得出的結論正確的是
選項 | 實驗操作 | 實驗現象 | 結論 |
A | 濃硫酸與乙醇170℃共熱,制得的氣體通入酸性KMnO4溶液 | 溶液紫色褪去 | 制得的氣體為乙烯 |
B | 測定等濃度的Na2CO3和Na2SO3的溶液的pH | 前者pH比后者的大 | 非金屬性:S>C |
C | 向2.0ml濃度均為0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振蕩 | 沉淀呈黃色 | Ksp(AgCl)>Ksp(AgI) |
D | 向待測液中先滴加Ba(NO3)2溶液, 再滴加稀鹽酸 | 出現白色沉淀 | 原待測液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源:2017屆浙江省高三3月高考模擬化學試卷(解析版) 題型:實驗題
某廢催化劑含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS及少量的Fe3O4。某同學用15.0 g該廢催化劑為原料,回收鋅和銅。采用的實驗方案如下,回答下列問題:
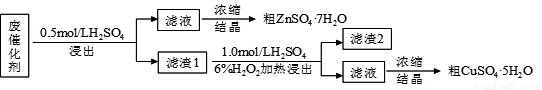
已知:ZnS與稀硫酸反應,且化合價不變; CuS既不溶解于稀硫酸,也不與稀硫酸反應
(1)在下列裝置中,第一次浸出反應裝置最合理的___________(填標號)。

(2)濾液1中含有Fe2+,選用提供的試劑進行檢驗,檢驗方法如下: 。
(提供的試劑:稀鹽酸 KSCN溶液 KMnO4溶液 NaOH溶液 碘水)
(3)本實驗要用到抽濾,設所用的洗滌劑為X,抽濾洗滌沉淀的操作 。
(4)寫出第二次浸出的化學反應方程式 ,向盛有濾渣1的反應器中加H2SO4和H2O2溶液,應先加 。
(5)濾渣2的主要成分是 。濃縮、結晶得到硫酸鋅晶體的主要儀器名稱是 。
(6)某同學在實驗完成之后,得到1.50 g CuSO4·5H2O,則銅的回收率為___________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com