
分析 (1)恒溫恒壓條件下向平衡體系中通入氬氣,體積增大,等效為降低壓強,平衡向體積增大的方向移動;
反應熱只與始態與狀態有關,催化劑改變平衡建立的途徑,不影響始態與終態,反應熱不變;
(2)根據電荷守恒判斷銨根離子濃度和氯離子濃度相對大小;
(3)Mg(OH)2、Cu(OH)2的結構類型相同,溶度積越小,溶解度越小,加入相同的濃度的氨水,最先析出;
(4)原電池的正極上發生得電子的還原反應,負極發生失電子的氧化反應,據此分析.
解答 解:(1)恒溫恒壓條件下向平衡體系中通入氬氣,體積增大,等效為降低壓強,平衡向體積增大的方向移動,該反應正反應是體積減小的反應,故平衡向左移動.
反應熱只與始態與狀態有關,催化劑改變平衡建立的途徑,不影響始態與終態,反應熱不變,
故答案為:向左;不改變;
(2)溶液中存在電荷守恒,c(NH4+)+c(H+)=c(Cl-)+c(OH-),由于c(NH4+)>c(Cl-),故c(H+)<c(OH-),溶液呈堿性,故答案為:堿;
(3)Mg(OH)2、Cu(OH)2的結構類型相同,Cu(OH)2溶度積更小,溶解度越小,加入相同的濃度的氨水,Cu(OH)2最先析出,反應離子方程式為:Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;
故答案為:Cu(OH)2;Cu2++2NH3.H2O=Cu(OH)2↓+2NH4+;
(4)正極上氮氣得電子和氫離子反應生成銨根離子,即電極反應為N2+8H++6e-═2NH4+,所以正極附近的pH增大,負極為氫氣失電子發生氧化反應,反應式為:H2-2e-═2H+;故答案為:增大;H2-2e-═2H+.
點評 本題考查化學平衡影響因素、離子濃度比較、難溶電解質的沉淀問題、燃料電池的工作原理和規律知識,比較綜合,難度中等.


 名師指導期末沖刺卷系列答案
名師指導期末沖刺卷系列答案科目:高中化學 來源: 題型:解答題
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
 ,產物的結構簡式為
,產物的結構簡式為 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
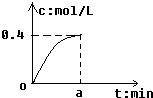 反應2SO2+O2?2SO3經amin后,SO3濃度的變化情況如圖所示,在時間0-amin內用O2表示的平均反應速率為0.04mol/(L•min),則a等于( )
反應2SO2+O2?2SO3經amin后,SO3濃度的變化情況如圖所示,在時間0-amin內用O2表示的平均反應速率為0.04mol/(L•min),則a等于( )| A. | 0.1 | B. | 2.5 | C. | 5 | D. | 10 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 130ml | B. | 100ml | C. | 90ml | D. | 50ml |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Y的價層電子排布式為3s23p5 | |
| B. | 穩定性:Y的氫化物>Z的氫化物 | |
| C. | 第一電離能:Y<Z | |
| D. | X、Y兩元素形成的化合物為離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 有可逆反應mA(s)+nB(g)═pC(g)+qD(g),反應過程中,當其它條件不變時,C的質量分數與溫度(T)和壓強(P)的關系如圖所示,根據圖中曲線分析,判斷下列敘述中,正確的是( )
有可逆反應mA(s)+nB(g)═pC(g)+qD(g),反應過程中,當其它條件不變時,C的質量分數與溫度(T)和壓強(P)的關系如圖所示,根據圖中曲線分析,判斷下列敘述中,正確的是( )| A. | 到達平衡后,若使用催化劑,C的質量分數增大 | |
| B. | 平衡后,若升高溫度,平衡則向逆反應方向移動 | |
| C. | 平衡后增大A的量,有利于提高A的轉化率 | |
| D. | 化學方程式中一定是m+n<p+q |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com