
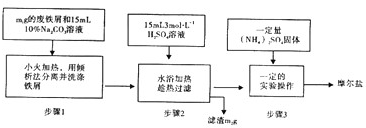
分析 廢鐵屑在碳酸鈉溶液中洗滌除去表面的油污,小火加熱用傾析法分離洗滌鐵屑,加入稀硫酸溶液水浴加熱、趁熱過濾,得到濾液中加入一定量硫酸銨固體,溶液表面出現晶膜時,停止加熱,蒸干時溶液中的雜質離子會被帶入晶體中,溫度過高晶體分解貨被空氣中氧氣氧化,采取蒸發濃縮、冷卻結晶方法,通過減壓過濾(或抽濾)等得到較為干燥的晶體,
I.(1)Na2CO3溶液中CO32-水解使Na2CO3溶液呈堿性,油脂在碳酸鈉溶液中水解生成溶于水的物質;
(2)步驟3中,加入(NH4)2SO4固體后,因為溫度過高晶體分解貨被空氣中氧氣氧化,則采取蒸發濃縮、冷卻結晶方法,通過減壓過濾(或抽濾)等得到摩爾鹽晶體;
(3)步驟3中,加入(NH4)2SO4固體后,溶液表面出現晶膜時,停止加熱,蒸干時溶液中的雜質離子會被帶入晶體中,溫度過高晶體分解貨被空氣中氧氣氧化;
Ⅱ.(1)根據實驗操作的步驟以及每步操作需要儀器確定反應所需儀器,實驗具體操作步驟有:計算、稱量、溶解、冷卻、移液、洗滌移液、定容、搖勻等;
(2)MnO4-為紫色,當滴入最后一滴KMnO4溶液,紫色不褪去,說明滴定到終點;
(3)滴定的一般步驟:①使滴定管內的標準KMnO4溶液滴入錐形瓶中;
②邊滴邊振蕩錐形瓶;
③眼睛注意觀察錐形瓶中溶液顏色的變化和加入KMnO4溶液的速度:
④接近終點時應該減慢加入KMnO4溶液的速度.當溶液由無色變為淺紅色,半分鐘內不褪色,即達到滴定終點;
(4)Fe2+被MnO4-氧化成三價鐵離子,本身被還原成二價錳離子,據此書寫離子方程式,根據離子方程式,計算8g產品中Fe2+的物質的量,進而計算Fe2+的質量,再根據質量分數定義計算.
解答 解:I.(1)Na2CO3溶液中CO32-水解CO32-+H2O?HCO3-+OH-,使Na2CO3溶液呈堿性,Na2CO3的主要作用是除去鐵屑表面的油污,
故答案為:除去鐵屑表面的油污;
(2)步驟3中,加入(NH4)2SO4固體后,因為溫度過高晶體分解貨被空氣中氧氣氧化,則采取蒸發濃縮、冷卻結晶方法,通過減壓過濾(或抽濾)等得到摩爾鹽晶體,故答案為:冷卻結晶;減壓過濾(或抽濾);
(3)步驟3中,加入(NH4)2SO4固體后,溶液表面出現晶膜時,停止加熱,蒸干時溶液中的雜質離子會被帶入晶體中,溫度過高晶體分解貨被空氣中氧氣氧化,故答案為:溶液表面出現晶膜時;蒸干時溶液中的雜質離子會被帶入晶體中,蒸干時晶體會受熱分解或氧化;
Ⅱ.(1)一定規格的容量瓶只能配制相應體積的溶液,容量瓶應選擇250ml規格;
溶液配制步驟為:一般用托盤天平稱量,用藥匙取用藥品,在燒杯中溶解(可用量筒量取水),用玻璃棒攪拌,冷卻后轉移到250mL容量瓶中,并用玻璃棒引流,洗滌并將洗滌液移入容量瓶中,當加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加至溶液凹面與刻度線水平相切,蓋好瓶塞,搖勻,
所以需要的儀器為:托盤天平、藥匙、燒杯、筒量、玻璃棒、250ml容量瓶、膠頭滴管,故上述儀器配制溶液時還需要的玻璃儀器是:250mL容量瓶,
故答案為:250mL容量瓶;
(2)MnO4-為紫色,當滴入最后一滴KMnO4溶液,紫色不褪去,說明滴定到終點,故不需要外加指示劑,故選:D;
(3)滴定的一般步驟:①使滴定管內的標準KMnO4溶液滴入錐形瓶中;
②邊滴邊振蕩錐形瓶;
③眼睛注意觀察錐形瓶中溶液顏色的變化和加入KMnO4溶液的速度:
④接近終點時應該減慢加入KMnO4溶液的速度.當溶液由無色變為淺紅色,半分鐘內不褪色,即達到滴定終點;
故答案為:邊滴邊振蕩錐形瓶;溶液由無色變為淺紅色,半分鐘內不褪色;
(4)Fe2+被MnO4-氧化成三價鐵離子,本身被還原成二價錳離子,離子方程式為:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
令4g產品中Fe2+的物質的量為xmol,則:
5Fe2+~~~~~~MnO4-,
5 1
xmol 0.02L×0.2mol/L
所以x=$\frac{0.02L×0.2mol/L×5}{1}$=0.02mol.
所以8g產品中Fe2+的質量0.02mol×56g/mol=1.12g,所以8g產品中Fe2+的質量分數為$\frac{1.12g}{8g}$×100%=14%.
故答案為:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;14%.
點評 本題以莫爾鹽的制備為載體,考察鹽類水解、氧化還原反應、氧化還原反應滴定應用、物質分離提純等有關實驗操作以及在新情境下綜合運用知識解決問題的能力.題目難度中等,注意基礎知識的全面掌握.


科目:高中化學 來源: 題型:選擇題
| A. | 只有③④ | B. | 只有①② | C. | 只有①③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
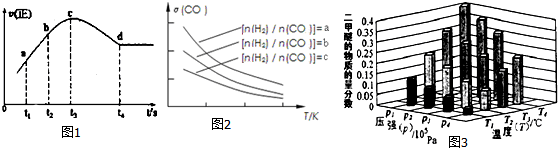
| 1.0 MPa | 2.0 MPa | 3.0 MPa | |
| 800℃ | a | b | 83% |
| 900℃ | c | 75% | d |
| 1000℃ | 54% | e | f |
| A. | 4個 | B. | 3個 | C. | 2個 | D. | 1個 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Li2NH中N的化合價是-1 | |
| B. | 此法儲氫和鋼瓶儲氫的原理相同 | |
| C. | 每有1molLi2NH參加反應,則有2mol電子轉移 | |
| D. | 該反應中H2既是氧化劑,又是還原劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “青蒿一握,以水二升漬,絞取汁”,屠呦呦對青蒿素的提取屬于化學變化 | |
| B. | “霾塵積聚難見路人”,霧霾所形成的氣溶膠有丁達爾效應 | |
| C. | “熬膽礬鐵釜,久之亦化為銅”,該過程發生了置換反應 | |
| D. | 維生素C具有還原性,在人體內起抗氧化作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
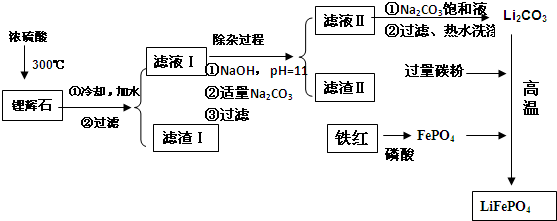
| 溫度/℃ | 20 | 40 | 60 | 80 |
| 溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
| 溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com