
【題目】工業上以氯氣和石灰乳為原料制造漂白粉.漂白粉的有效成分是( )
A.Cl2
B.CaCl2
C.Ca(OH)2
D.Ca(ClO)2
 千里馬走向假期期末仿真試卷寒假系列答案
千里馬走向假期期末仿真試卷寒假系列答案科目:高中化學 來源: 題型:
【題目】SO2雖是大氣污染物之一,但也是重要的工業原料,某同學在實驗室設計如下實驗,對SO2的部分性質進行了探究。
(1)二氧化硫的水溶液
①SO2易溶于水,常溫常壓下溶解度為1:40,其中有H2SO3生成。向SO2的飽和溶液中加入NaHSO3固體,有氣體冒出,原因是__________。(結合有關平衡方程式簡要說明)
②欲驗證酸性:H2SO3>HClO,選用下面的裝置,其連接順序為:
A![]() ________(按氣流方向用大寫字母表示即可)。能證明H2SO3的酸性強于HClO的實驗現象為___。
________(按氣流方向用大寫字母表示即可)。能證明H2SO3的酸性強于HClO的實驗現象為___。
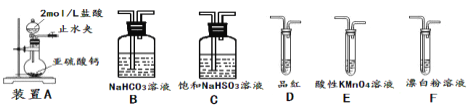
(2)二氧化硫的還原性
已知SO2具有還原性,可以還原I2,可以與Na2O2發生反應,按圖示裝置進行實驗。(部分固定裝置未畫出)
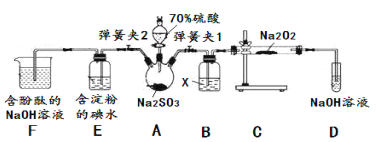
操作步驟 | 實驗現象 | 解釋原因 |
關閉彈簧夾2,打開彈簧夾1,注入硫酸至浸沒三頸燒瓶中固體 | 若將帶火星的木條放在D試管口處,木條不復燃 | SO2與Na2O2反應無O2生成,可能發生的化學反應方程式為①____ |
若將帶火星的木條放在D試管口處,木條復燃 | SO2與Na2O2反應有O2生成,發生的化學反應為:2SO2+2Na2O2=2Na2SO3+O2 | |
關閉彈簧夾1,打開彈簧夾2,殘余氣體進入E,F中。 | E中②__________ | E中反應的離子方程式③________ |
F中④__________ | F中反應為2OH-+SO2=SO32-+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列解釋事實的方程式不正確的是( )
A.測0.1mol/L氨水的pH為11:NH3·H2O![]() NH4++OH-
NH4++OH-
B.將Na塊放入水中,產生氣體:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做導電性實驗,燈泡發光:CuCl2 =Cu2++2Cl-
D.Al片溶于NaOH溶液中,產生氣體:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
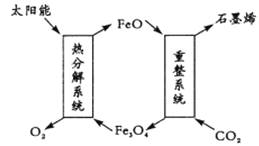
【題目】二氯化碳利用具有十分重要的意義,科學家有以下幾個設想。
(1)用太陽能將CO2轉化成O2和C(石墨烯),其設想如下:
①Fe3O4中Fe的化合價是+ 2和 __________;
②重整系統發生反應的化學方程式為______________________________。
(2)二氧化碳和氫氣在催化劑作用下可制取低碳烯烴。在一密閉容器中分別投入1molCO2、3molH2,發生反應:2CO2(g)+6H2(g)![]() C2H4 (g)+ 4H2O(g) △H;在不同溫度下,用傳感技術測出平衡時H2的物質的量變化關系如右下圖所示。
C2H4 (g)+ 4H2O(g) △H;在不同溫度下,用傳感技術測出平衡時H2的物質的量變化關系如右下圖所示。
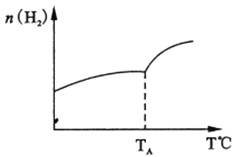
① 其它條件不變,起始時若按lmolCO2、2molH2進行投料,CO2轉化率將_____________(填“增大”、“ 減小”或“不變”);
②△H________0(填“>”“<”“ 不能確定”)。
③若測試中體系內無氧氣產生,試結合圖示推斷熱穩定性C2H4 ________ H2O (填“>”“<”“ 不能確定”)。
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3·H2O(aq) ![]() NH4+ (aq) +OH-(aq) △H1=a kJmol-1
NH4+ (aq) +OH-(aq) △H1=a kJmol-1
CO2 (g) + H2O(l)![]() H2CO3 (aq) △H2=bkJmol-1
H2CO3 (aq) △H2=bkJmol-1
H2CO3(aq) + OH-(aq)![]() HCO3-(aq) + H2O(l) △H3=ckJmol-1
HCO3-(aq) + H2O(l) △H3=ckJmol-1
則利用NH3 H2O吸收CO2制備NH4HCO3的熱化學方程式為_____________________________;
②已知常溫下相關數據如表:
Kb(NH3·H2O) | 2×10-5mol L-1 |
Ka1(H2CO3) | 4×10-7mol L-1 |
Ka2(H2CO3) | 4×10-11mol L-1 |
則反應NH4++HCO3-+H2O![]() NH3 H2O+ H2CO3的平衡常數k=___________。
NH3 H2O+ H2CO3的平衡常數k=___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某金屬與稀硝酸反應生成一種硝酸鹽,該硝酸鹽受熱分解生成NO2、O2和一種固體,該固體中金屬元素的化合價比原硝酸鹽中該金屬的化合價高,則該硝酸鹽分解后生成的NO2和O2的物質的量之比為 ( )
A. 8∶1 B. 4∶1 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D 4種元素,其中A、B、C為短周期元素,A元素所處的周期數、主族序數、原子序數均相等;B的原子半徑是其所在主族中最小的,B的最高價氧化物對應水化物的化學式為HBO3;C元素原子的最外層電子數比次外層少2個;C的陰離子與D的陽離子具有相同的電子排布,兩元素可形成化合物D2C。
(1)B元素的名稱 ;B在周期表中的位置第 周期,第 族;
(2)A、B形成的化合物的電子式 ;
(3)C的元素符號 ,C的最高價氧化物的化學式 ;
(4)D的最高價氧化物對應的水化物的化學式 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示,把試管放入盛25℃時飽和石灰水的燒杯中,試管中開始放入幾小塊鎂片,再用滴管滴入5mL鹽酸于試管中.試完成下列問題(提示:氫氧化鈣的溶解度隨溫度升高而降低)

(1)實驗中觀察到的現象是 ;
(2)產生上述現象的原因是 .
(3)寫出有關反應的離子方程式 .
(4)由實驗推知,MgCl2溶液和H2的總能量 (填“大于”“小于”或“等于”)鎂片的鹽酸的總能量.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列各化合物中,均為弱電解質的一組是
A. H2CO3 Ba(OH)2 K2S H3PO4 B. FeCl3 HCl C2H5OH NH4Cl
C. CH3COOH H2CO3 Cu(OH)2 H2O D. HCl KNO3 H2CO3 H2SO4
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com