
【題目】碳酸鈉俗稱純堿,其用途很廣。實驗室中,用碳酸氫銨和飽和食鹽水可制得純堿。
(1)飽和食鹽水所用的原料粗鹽主要來自于海洋,從海水中得到粗鹽我們通常用的方法是_______。
(2)所得的粗鹽(含Ca2+、Mg2+、SO42-)需要提純,需要加入足量NaOH、BaCl2、Na2CO3溶液將雜質離子除去,隨后過濾并加入鹽酸調pH至7。其中先用BaCl2,再用Na2CO3的原因是______。
(3)飽和食鹽水除用于制純堿,也是氯堿工業的原料。氯堿工業中電解飽和食鹽水的方程式為_______。
(4)測試純堿產品中NaHCO3含量的方法是:用_______(定量儀器)稱取純堿樣品1.144g,用蒸餾水溶解,加入0.500mol/L的HCl溶液100mL,再加1-2滴酚酞,繼續用0.500mol/L標準氫氧化鈉溶液滴定。當滴定至溶液由_____色變_____色,半分鐘不變色為滴定終點。
(5)若上述過程中共消耗氫氧化鈉58.00mL,純堿樣品中NaHCO3質量分數為_____。(保留3位小數)
(6)如果裝氫氧化鈉的滴定管滴定結束讀數時有漏液情況,會導致測定結果______(選填“偏大”、“偏 小”、“不受影響”)。
【答案】蒸發法 Na2CO3可以出去過量的 BaCl2,過量的Na2CO3可以通過鹽酸除去 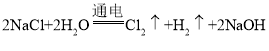 電子天平 無 紅 0.073 偏大
電子天平 無 紅 0.073 偏大
【解析】
(1)根據NaCl溶解度受溫度影響變化不大分析;
(2)除去雜質不能引入新的雜質,或者引入新雜質后要容易除去;
(3)電解飽和NaCl溶液反應產生NaOH、Cl2、H2;
(4)準確稱量一定質量的固體用電子天平;加入鹽酸,HCl與Na2CO3、NaHCO3反應產生NaCl,鹽酸過量,用酚酞為指示劑,滴加NaOH溶液時,過量HCl與NaOH反應產生NaCl和水當滴定達到終點時,溶液由無色變為紅色;
(5)根據消耗的HCl、NaOH的體積計算其中NaHCO3的質量,進而可得純堿的純度;
(6)根據溶液的體積對物質的量的影響分析判斷。
(1)由于NaCl在水中的溶解度受溫度影響變化不大,將NaCl從海水中分離出來,可采用蒸發溶劑的方法;
(2)向得到的含Ca2+、Mg2+、SO42-的粗鹽需要提純,先加入需要加入足量BaCl2溶液,使SO42-形成BaSO4沉淀,再加入Na2CO3溶液,既可以除去NaCl溶液中的Ca2+形成CaCO3沉淀,也可以將過量的BaCl2形成BaCO3沉淀,再加入NaOH溶液,使Mg2+形成 Mg(OH)2沉淀,過量的Na2CO3可以通過鹽酸除去;
(3)在工業上通常采用電解飽和NaCl溶液的方法制取,反應方程式為: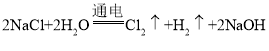 ;
;
(4)準確稱量一定質量的固體用電子天平;加入鹽酸,HCl與樣品中的Na2CO3、NaHCO3反應產生NaCl,加入的鹽酸過量,用酚酞為指示劑,滴加NaOH溶液時,過量HCl與NaOH反應產生NaCl和水當滴定達到終點時,溶液由無色變為紅色;
(5)根據題意,加入的HCl與Na2CO3、NaHCO3、NaOH最終產生NaCl,假設樣品中Na2CO3、NaHCO3的物質的量分別是x、y,根據元素守恒可得2x+y+n(NaOH)=n(HCl),即2x+y= n(HCl)-n(NaOH)=0.500mol/L×(0.1-0.058)L=0.021mol,根據質量守恒可得106x+84y=1.144g,兩式聯立,可得x=0.01mol,y=0.001mol,所以樣品中NaHCO3的質量為m(NaHCO3)=0.001mol×84g/mol=0.084g,純堿樣品中NaHCO3質量分數為(0.084g÷1.144g)×100%=0.073;
(6)如果裝氫氧化鈉的滴定管滴定結束讀數時有漏液情況,則反應消耗的NaOH體積偏大,使的樣品中Na2CO3的質量偏小,則NaHCO3的質量偏大,最終會導致測定結果偏大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:
【題目】某溶液中可能存在Br-、CO![]() 、SO
、SO![]() 、Al3+、I-、Mg2+、Na+等7種離子中的某幾種。現取該溶液進行實驗,得到如下現象:
、Al3+、I-、Mg2+、Na+等7種離子中的某幾種。現取該溶液進行實驗,得到如下現象:
①向溶液中滴加足量氯水后,溶液變橙色,且有無色氣泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,無沉淀生成;
③向所得溶液中繼續滴加淀粉溶液,溶液不變藍色。
已知:5Cl2+I2+6H2O===10HCl+2HIO3
據此可以判斷:該溶液肯定不存在的離子組是
A. Al3+、Mg2+、SO![]() B. Mg2+、CO
B. Mg2+、CO![]() 、I-
、I-
C. Al3+、SO![]() 、I- D. Al3+、Br-、SO
、I- D. Al3+、Br-、SO![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Cu2O是一種半導體材料,基于綠色化學理念設計的制取Cu2O的電解池示意圖如右,電解總反應為:2Cu+H2O![]() Cu2O+H2↑。下列說法正確的是
Cu2O+H2↑。下列說法正確的是
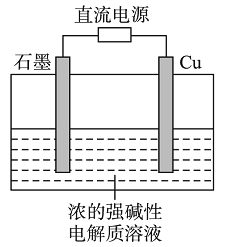
A. 石墨電極上產生氫氣
B. 銅電極發生還原反應
C. 銅電極接直流電源的負極
D. 當有0.1 mol電子轉移時,有0.1 mol Cu2O生成
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有A、B、C、D、E五種陰陽離子均不相同的化合物,五種陽離子為![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() ,五種陰離子為
,五種陰離子為![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 現將它們分別配成
現將它們分別配成![]() 的溶液,進行如下實驗
的溶液,進行如下實驗
![]() 測得溶液A、B呈堿性,且堿性為
測得溶液A、B呈堿性,且堿性為![]() ;
;
![]() 向C溶液中滴加稀鹽酸,有氣體生成;
向C溶液中滴加稀鹽酸,有氣體生成;
![]() 向D溶液中滴加NaOH溶液,先岀現沉淀,繼續滴加,沉淀消失
向D溶液中滴加NaOH溶液,先岀現沉淀,繼續滴加,沉淀消失
請根據上述實驗現象,回答下列問題
![]() 實驗
實驗![]() 中發生反應的化學方程式為______________;向C中滴加NaOH溶液,出現的現象為_________。
中發生反應的化學方程式為______________;向C中滴加NaOH溶液,出現的現象為_________。
![]() 分兩步寫出實驗
分兩步寫出實驗![]() 中發生反應的離子方程式______________。
中發生反應的離子方程式______________。
![]() 寫出下列四種化合物的化學式:A______________;B______________。
寫出下列四種化合物的化學式:A______________;B______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,密閉可變容器中發生可逆反應N2+3H2![]() 2NH3能說明反應已達到平衡狀態的是
2NH3能說明反應已達到平衡狀態的是
A.以上三種物質的濃度相等B.壓強恒定
C.2v正(H2)=3v逆(NH3)D.v正(N2)=3v逆(H2)
查看答案和解析>>
科目:高中化學 來源: 題型:
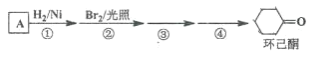
【題目】環己酮是工業上主要用作有機合成的原料和溶劑,可由最簡單芳香烴A經如下流程制得:
回答下列問題:
(1)反應①的反應類型為_______反應,反應③的反應類型為______。
(2)反應④所用的試劑為_______。
(3)A的同系物(C8H10)所有可能的結構簡式為_______。
(4)環己酮的還原產物能與乙酸產生乙酸酯,請寫出產生酯的條件。_______
(5)寫出A的相鄰同系物合成![]() 的合成路線。合成路線常用的表示方式為:______
的合成路線。合成路線常用的表示方式為:______
A![]() B……
B……![]() 目標產物
目標產物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于有機化合物的說法不正確的是
A. 1,3-二甲苯也稱間二甲苯
B. 乙烷和新戊烷分子中所含甲基數之比為1∶2
C. 苯與溴水不能發生加成反應,所以兩者混合后無明顯現象
D. ![]() 和C4H10的二氯代物的數目不同(不含立體異構)
和C4H10的二氯代物的數目不同(不含立體異構)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有pH均為2的鹽酸、硫酸、醋酸三瓶溶液
(1)設三種溶液的物質的量濃度依次為c1、c2、c3,則其關系是________________________(用“>、<、=”表示,下同)。
(2)取同體積的三種酸分別加蒸餾水稀釋到pH=6,需水的體積依次為V1、V2、V3,則其關系是___________________________。
(3)完全中和體積和物質的量濃度均相同的三份NaOH溶液時,需三種酸的體積依次為V1、V2、V3,則其關系是____________________________。
(4)取同體積的酸的溶液分別加入足量的鋅粉,反應過程中放出H2的速率依次為a1、a2、a3,則其關系是___________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如下圖所示:

已知A、D、E、F是中學化學中常見的單質,B、C是氧化物,且B的式量是232。請填空:
(1)A是______________,E是______________。(填化學式)
⑵D跟水反應的化學方程式為______________。
⑶C電解時,每生成1 molA,同時生成______________mol E。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com