
 物質A、E、F的焰色反應呈黃色,物質I的1個分子由4個原子組成并共含有10個電子,B、C、D、K在常溫下都是氣體單質,G在常溫下是無色液體,反應①~⑤都是用于工業生產的反應,各有關物質之間的相互反應轉化關系如圖所示(部分反應條件已略去):
物質A、E、F的焰色反應呈黃色,物質I的1個分子由4個原子組成并共含有10個電子,B、C、D、K在常溫下都是氣體單質,G在常溫下是無色液體,反應①~⑤都是用于工業生產的反應,各有關物質之間的相互反應轉化關系如圖所示(部分反應條件已略去):
分析 A、E、F的焰色反應呈黃色,說明都含有鈉元素,B、C、D、K在常溫下都是氣體單質,物質I的1個分子由4個原子組成并共含有10個電子,則I應為NH3,反應①~⑤都是用于工業生產的反應,則反應⑤應為氨的催化氧化,所以K為O2,G在常溫下是無色液體,所以G為H2O,則J為NO,C、D為N2、H2中的一種,M在光照條件下生成氧氣,應為次氯酸的見光分解,所以M為HClO,H為HCl,則B為Cl2,C為H2,D為N2,E為NaClO,F、G電解生成A、B、C,應為工業上電解飽和食鹽水,所以A為NaOH,則F為NaCl,反應①為工業上用堿吸收氯氣的反應,據此答題.
解答 解:A、E、F的焰色反應呈黃色,說明都含有鈉元素,B、C、D、K在常溫下都是氣體單質,物質I的1個分子由4個原子組成并共含有10個電子,則I應為NH3,反應①~⑤都是用于工業生產的反應,則反應⑤應為氨的催化氧化,所以K為O2,G在常溫下是無色液體,所以G為H2O,則J為NO,C、D為N2、H2中的一種,M在光照條件下生成氧氣,應為次氯酸的見光分解,所以M為HClO,H為HCl,則B為Cl2,C為H2,D為N2,E為NaClO,F、G電解生成A、B、C,應為工業上電解飽和食鹽水,所以A為NaOH,則F為NaCl,反應①為工業上用堿吸收氯氣的反應,
(1)根據上面的分析可知,B為Cl2,M為HClO,
故答案為:Cl2;HClO;
(2)A為NaOH,其電子式為 ,
,
故答案為: ;
;
(3)E為NaClO,ClO-會發生水解,溶液呈堿性,所以0.1mol/LE水溶液中各離子濃度由大到小的順序為c(Na+)>c(ClO-)>c(OH-)>c(H+),
故答案為:c(Na+)>c(ClO-)>c(OH-)>c(H+);
(4)反應①為工業上用堿吸收氯氣的反應,離子方程式為Cl2+2OH-=Cl-+ClO-+H2O,反應⑤的化學方程式為4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O,
故答案為:;4NH3+5O2$\frac{\underline{催化劑}}{△}$4NO+6H2O;
(5)電解食鹽水的反應中,若轉移0.02mol電子,可得0.02molOH-,溶液的體積是200mL,則此時溶液的c(OH-)=$\frac{0.02mol}{0.2L}$=0.1mol/L,所以溶液中PH=13,
故答案為:13.
點評 本題主要考查了氯、氮等元素及其化合物知識,中等難度,涉及電子式、離子濃度比較、離子方程式、pH值的計算等,物質推斷是解題的關鍵,要學會根據特征反應及現象進行推斷,要熟練掌握常見的反應在工業中的應用.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
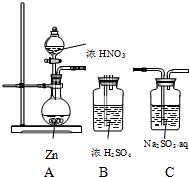 甲同學探究NO2的氧化性;設計了如下實驗裝置:
甲同學探究NO2的氧化性;設計了如下實驗裝置:| 步驟 | 現象 | 結論 |
| 取少量C中反應后的溶液 置于試管中, 先加入鹽酸溶液酸化,再加入 氯化鋇溶液 | 有白色沉淀產生 | NO2具有氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cl2 | B. | Fe3+ | C. | HNO3 | D. | MnO4- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向燒堿溶液中滴加少量氯化鋁溶液:Al3++4OH-═AlO2-+2H2O | |
| B. | 物質的量相等的溴化亞鐵跟氯氣反應:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 硫化鉀晶體溶于水:S2-+2H2O?2OH-+H2S | |
| D. | 向碳酸鈉溶液中滴加過量的稀硫酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
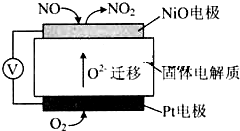 某市對大氣進行監測,發現該市首要污染物為可吸入顆粒物PM2.5(直徑小于等于2.5um的懸浮顆粒物)其主要來源為燃煤、機動車尾氣等.因此,對PM2.5、SO2、NOx等進行研究具有重要意義.請回答下列問題:
某市對大氣進行監測,發現該市首要污染物為可吸入顆粒物PM2.5(直徑小于等于2.5um的懸浮顆粒物)其主要來源為燃煤、機動車尾氣等.因此,對PM2.5、SO2、NOx等進行研究具有重要意義.請回答下列問題:| 離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 濃度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
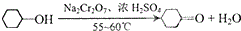 實驗室用Na2Cr2O7氧化環己醇制取環己酮(已知該反應為放熱反應):
實驗室用Na2Cr2O7氧化環己醇制取環己酮(已知該反應為放熱反應):| 物質 | 沸點( ) | 密度(g.cm-3,20) | 溶解性 |
| 環己醇 | 161.1(97.8) | 0.9624 | 能溶于水和乙醚 |
| 環己酮 | 155.6(95) | 0.9478 | 微溶于水,能溶于乙醚 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
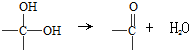
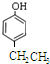
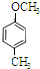
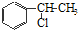 、
、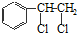 等都是A和Cl2發生反應生成的產物,E是一種發生加聚反應的聚合物物,透光性能好,常用作一些燈飾外殼.過程中一些小分子都已經略去
等都是A和Cl2發生反應生成的產物,E是一種發生加聚反應的聚合物物,透光性能好,常用作一些燈飾外殼.過程中一些小分子都已經略去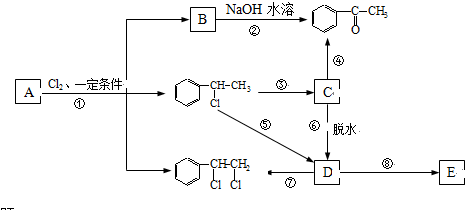
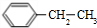 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$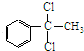 +2HCl,該反應類型為取代反應;
+2HCl,該反應類型為取代反應;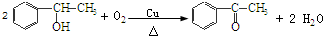 ,該反應類型為氧化反應;
,該反應類型為氧化反應;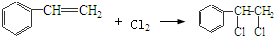 ,該反應類型為加成反應;
,該反應類型為加成反應;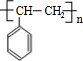 ;
; 、
、 、
、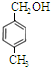 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com