
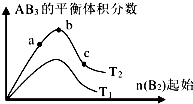
| A. | 反應速率a>b>c | |
| B. | 達到平衡時 A2的轉化率大小為:b>a>c | |
| C. | 若T2>T1,則正反應一定是吸熱反應 | |
| D. | 達到平衡時,AB3的物質的量大小為:b>c>a |
分析 由圖可知,B2起始相同時,T2對應的AB3的含量大,則若該正反應為吸熱反應,則T2>T1,若該正反應為放熱反應,則T2<T1;由圖可知B2越大,達到平衡時A2的轉化率越大,且b點AB3的體積分數最大,則反應物的物質的量之比接近等于化學計量數之比,以此來解答.
解答 解:A、根據圖象可知,a、b、c各點中B的起始物質的量依次增大,則反應物的濃度依次增大,反應速率依次增大,反應速率b>a>c,故A錯誤;
B、對于可逆反應來說,增大一種反應物的物質的量或濃度,有利于平衡向正反應方向移動,生成物的物質的量增多,所以達到平衡時,AB3的物質的量大小為:c>b>a,故B錯誤;
C、若T2>T1,由圖象可知溫度升高生成物的物質的量增大,說明升高溫度平衡向正反應分析移動,則正反應為吸熱反應,故C正確;
D、根據圖象可知,a、b、c各點中B的起始物質的量依次增大,對于可逆反應來說,增大一種反應物的物質的量或濃度,有利于平衡向正反應方向移動,則另一種反應物的轉化率增大,則達到平衡時A2的轉化率大小為:c>b>a,故D錯誤.
故選C.
點評 本題考查化學反應速率及化學平衡圖象,明確橫坐標為反應物B2的物質的量及該反應可能為吸熱反應,也可能為放熱反應是解答本題的關鍵,題目難度較大.


 陽光課堂課時作業系列答案
陽光課堂課時作業系列答案科目:高中化學 來源: 題型:選擇題
| A. | 聚合反應符合“綠色化學工藝”要求,即原子利用率100% | |
| B. | 用聚乙烯塑料代替聚乳酸塑料可明顯減少白色污染 | |
| C. | 裝修材料中常揮發出有害氣體甲醛等,入住新居前放幾盆清水便可 | |
| D. | 乙醇、雙氧水在醫療上常用作殺菌消毒劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CuSO4 | B. | Na2CO3 | C. | K2SO4 | D. | Zn(NO3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaOH、KOH、CsOH堿性依次減弱 | |
| B. | Li、Na、K、Rb、Cs單質的失電子能力逐漸增強 | |
| C. | Li、Na、K、Rb、Cs的最外層電子數依次減小 | |
| D. | Li、Na、K、Rb、Cs電子層數相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3CH2Br$→_{△}^{NaOH水溶液}$CH3CH2OH$\stackrel{濃硫酸、170℃}{→}$CH2═CH2$\stackrel{Br_{2}}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 | |
| B. | CH3CH2Br$\stackrel{Br}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 | |
| C. | CH3CH2Br $\stackrel{NaOH醇溶液}{→}$CH2═CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{Br_{2}}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 | |
| D. | CH3CH2Br$\stackrel{NaOH醇溶液}{→}$CH2═CH2$\stackrel{HBr}{→}$CH2BrCH2Br$\stackrel{水解}{→}$乙二醇 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑,2H2+O2$\frac{\underline{\;點燃\;}}{\;}$2H2O | |
| B. | NH3+CO2+H2O═NH4HCO3,NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O↑+CO2↑ | |
| C. | H2+I2$\frac{\underline{\;\;△\;\;}}{\;}$2HI,2HI$\frac{\underline{\;\;△\;\;}}{\;}$H2↑+I2↑ | |
| D. | 2Ag+Br2$\frac{\underline{\;CuO\;}}{\;}$2AgBr,2AgBr$\frac{\underline{\;光\;}}{\;}$2Ag+Br2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 它是第Ⅷ族元素 | |
| B. | 它是第六周期元素 | |
| C. | 它屬于過渡元素 | |
| D. | 它的某種同位素核內中子數大于質子數 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com