
【題目】【化學-有機化學基礎】聚合物F的合成路線圖如下:
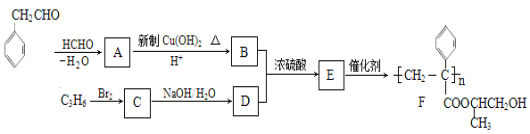
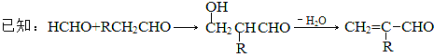
請據此回答:
(1) A中含氧官能團名稱是_______,C的系統命名為_________。
(2) 檢驗B中所含官能團所用的試劑有______;E→F的反應類型是___________。
(3)C生成D的反應化學方程式為_____________________________,如果C與NaOH的醇溶液反應,則生成的有機物的結構簡式為___________(同一個碳原子上連兩個碳碳雙鍵的除外)。
(4)G物質與![]() 互為同系物,且G物質的相對分子質量比
互為同系物,且G物質的相對分子質量比![]() 大14的,則符合下列條件的G的同分異構體有__________種。
大14的,則符合下列條件的G的同分異構體有__________種。
① 分子中含有苯環,且苯環上有兩個取代基 ② 遇氯化鐵溶液變紫色 ③ 能與溴水發生加成反應
(5) 參照上述合成路線,設計一條由甲醛、乙醛和甲醇為主要原料制備 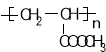 的合成路線 。
的合成路線 。
【答案】(1)醛基(1分);1,2-二溴丙烷(2分)
(2)NaHCO3溶液(或Na2CO3)、溴水(或Br2的CCl4溶液)(2分);加聚反應(1分)
(3)CH3CHBrCH2Br+2NaOH→CH3CH(OH)CH2OH+2NaBr(2分);CH3C≡CH(2分)
(4)9(2分)(5)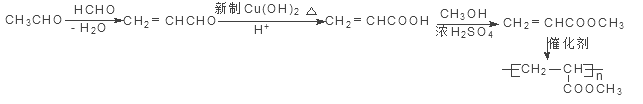
【解析】
試題分析:(1)根據已知信息,苯乙醛發生反應生成A,A為![]() ,其所含氧官能團為醛基;醛基變為羧基,據F的結構簡式可知,C3H6為丙烯,其與溴發出加成反應生成的C為1,2-二溴丙烷。
,其所含氧官能團為醛基;醛基變為羧基,據F的結構簡式可知,C3H6為丙烯,其與溴發出加成反應生成的C為1,2-二溴丙烷。
(2)B中含有的官能團為羧基和碳碳雙鍵,用碳酸氫鈉溶液檢驗羧基,用溴水檢驗碳碳雙鍵,E為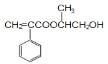 ,E通過加聚反應生成F。
,E通過加聚反應生成F。
(3)C為1,2-二溴丙烷,能水解生成D,D為1,2-二羥基丙醇,反應的化學方程式為CH3CHBrCH2Br+2NaOH →CH3CH(OH)CH2OH+2NaBr;C與氫氧化鈉的水溶液發生消去反應生成丙炔,結構簡式為CH3C≡CH。
(4)G物質與![]() 互為同系物,含有醛基 和苯環,G物質的相對分子質量比
互為同系物,含有醛基 和苯環,G物質的相對分子質量比![]() 大14,即多一個-CH2-部分,符合條件的G的同分異構體有C6H5-和-CH2CH2CHO或-CH(CH3)CHO兩種,HO-C6H4-和-CH=CHCH3或-CH2CH=CH2,苯環位置有鄰間對三種,有6種,含有C6H5-和-CH(CH3)CH=CH2,共9種。
大14,即多一個-CH2-部分,符合條件的G的同分異構體有C6H5-和-CH2CH2CHO或-CH(CH3)CHO兩種,HO-C6H4-和-CH=CHCH3或-CH2CH=CH2,苯環位置有鄰間對三種,有6種,含有C6H5-和-CH(CH3)CH=CH2,共9種。
(5)據已知反應可知,甲醛與乙醛發生羥醛縮合反應后失水生成CH2=CHCHO,然后用弱氧化劑新制氫氧化銅將醛基氧化為羧基,再與甲醇發生酯化反應生成CH2=CHCOOCH3,發生加聚反應可得![]() ,具體流程為:
,具體流程為:
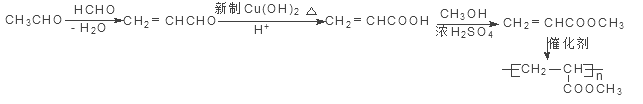 。
。


科目:高中化學 來源: 題型:
【題目】用氟硼酸(HBF4,屬于強酸)代替硫酸作鉛蓄電池的電解質溶液,可使鉛蓄電池在低溫下工作時的性能更優良,反應方程式為Pb+PbO2+4HBF4![]() 2Pb(BF4)2+2H2O,其中Pb(BF4)2為可溶于水的強電解質,用該鉛蓄電池分別電解AgNO3溶液和Na2SO3溶液,裝置如下圖,a、b、c、d電極材料均為石墨,通電時a電極質量增加。
2Pb(BF4)2+2H2O,其中Pb(BF4)2為可溶于水的強電解質,用該鉛蓄電池分別電解AgNO3溶液和Na2SO3溶液,裝置如下圖,a、b、c、d電極材料均為石墨,通電時a電極質量增加。
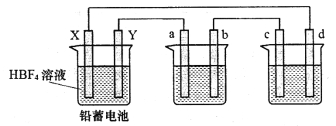
回答下列問題:
(1)d電極為該裝置的___________極,工作時,該池內d電極上無氣體產生,寫出該池內電解反應的離子方程式:_____________________。
(2)該鉛蓄電池放電時X極附近pH_____________ (填“增大”、“減小”或“不變”),正極的電極反應式為______________________。
(3)鉛蓄電池充電時,Y電極與電源的_________(填“正極”或“負極”)相連。
(4)另取一常規鉛蓄電池(濃硫酸作電解質溶液)與該鉛蓄電池同時放電,當電路中均通過1 mol電子時,分別取下Y電極稱重,兩電極質量相差__________g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是
A.化學只研究自然界中存在的物質
B.化學的特征是認識分子和制造分子
C.通過化學方法可以制造出使人長生不老的“仙丹”
D.化學的研究層面越來越廣,原子核的變化也已成為化學研究的范疇
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.稀醋酸中加入少量醋酸鈉能增大醋酸的電離程度
B.25 ℃時0.1 mol/L的硫化氫溶液比等濃度的硫化鈉溶液的導電能力弱
C.NaHCO3溶液中溶質的電離方程式為NaHCO3===Na++H++CO![]()
D.室溫下,對于0.10 mol·L-1的氨水,加水稀釋后,溶液中c(NH![]() )·c(OH-)變大
)·c(OH-)變大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從海水提取溴的過程中,吸收塔內溴蒸氣和吸收劑SO2發生的化學反應為:Br2+SO2+2H2O=2HBr+H2SO4 , 下列說法正確的是( )
A.SO2在反應中被還原
B.Br2在反應中失去電子
C.Br2在反應中表現氧化性
D.1mol氧化劑在反應中得到1mol電子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】配制下列溶液時常需加入少量括號內的物質,其中不是為了抑制離子水解的是
A.FeSO4(Fe) B.SnCl2(HCl) C.FeCl3(HCl) D.NaAlO2(NaOH)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是A分子的球棍模型和B分子的比例模型,回答下列問題:

(1)A和B的關系是 。
(2)寫出A分子在催化劑存在條件下加熱和氧氣反應的化學方程式 。
(3)寫出B分子和金屬鈉反應的化學方程式 。
(4)B在加熱條件下能夠和HBr發生反應生成溴乙烷,該反應類型是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學實驗是研究化學反應的有效方法。
Ⅰ.ClO2氣體是一種高效、廣譜、安全的殺菌消毒劑,可用NaClO3和草酸(H2C2O4)反應制得。無水草酸100℃可以升華。某學習小組用下圖裝置模擬工業制取收集ClO2 。
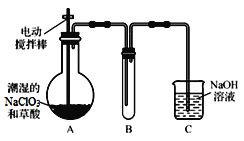
(1)實驗時裝置A需在60℃~100℃進行的原因是 ,控制所需溫度的方法是 。
(2)電動攪拌棒的作用是 。裝置A中反應產物有Na2CO3、ClO2和CO2等,該反應的化學方程式為 。
(3)在裝置C中ClO2和NaOH反應生成等物質的量的兩種鹽,其中一種鹽為NaClO2 ,寫出反應的離子方程式 。
Ⅱ. 某實驗小組以H2O2分解為例,研究濃度、催化劑、溶液酸堿性對反應速率的影響。在常溫下按照如下方案完成實驗。
實驗編號 | 反應物 | 催化劑 |
① | 10 mL 2% H2O2溶液 | 無 |
② | 10 mL 5% H2O2溶液 | 無 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1 FeCl3溶液 |
(1)實驗①和②的目的是_______________________。實驗時由于沒有觀察到明顯現象而無法得出結論。資料顯示,通常條件下H2O2穩定,不易分解。為了達到實驗目的,你對原實驗方案的改進是______________________。
(2)實驗③、④、⑤中,測得生成氧氣的體積隨時間變化的關系如下圖:

分析上圖能夠得出的實驗結論是________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有三組溶液:①汽油和氯化鈉溶液 ②39%的乙醇溶液 ③氯化鈉和單質溴的水溶液,分離以上各混合液的正確方法依次是
A.分液、萃取、蒸餾 B.萃取、蒸餾、分液
C.分液、蒸餾、萃取 D.蒸餾、萃取、分液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com