

分析 工業大理石(含有少量Al3+、Fe3+等雜質)制備溴化鈣,工業大理石加入氫溴酸酸溶生成溴化鈣、溴化鋁、溴化鐵,然后向溶液中加入試劑a,目的是除去Al3+和Fe3+,除雜時要除去雜質且不引進新的雜質,Al3+和Fe3+能和堿反應生成沉淀,所以a應該選取石灰水;然后過濾,濾去沉淀;向濾液中加入氫溴酸,目的是除去過量的氫氧化鈣,最后將溶液蒸發濃縮、冷卻結晶、過濾得到CaBr2•6H2O;最后加熱固體得到較純凈的CaBr2;
(1)根據儀器的用途選取儀器;
(2)已知步驟Ⅲ的濾液中不含NH4+,步驟Ⅱ加入的試劑a要除去,Al3+和Fe3+且不能引進新的雜質;濾液中含有過量的氫氧化鈣,影響溴化鈣制取,所以要除去過量氫氧化鈣;
(3)從溶液中獲取晶體應該采用蒸發濃縮、冷卻結晶、過濾方法;洗滌的目的是洗去晶體表面的雜質;
(4)某工業尾氣中含有CO、CO2、SO2氣體,利用如圖2裝置對尾氣進行分步吸收(不轉化)或收集,二氧化硫和二氧化碳都是酸性氧化物,能和堿反應,二氧化硫還具有還原性,CO是不成鹽氧化物,且不溶于水.
解答 解:工業大理石(含有少量Al3+、Fe3+等雜質)制備溴化鈣,工業大理石加入氫溴酸酸溶生成溴化鈣、溴化鋁、溴化鐵,然后向溶液中加入試劑a,目的是除去Al3+和Fe3+,除雜時要除去雜質且不引進新的雜質,Al3+和Fe3+能和堿反應生成沉淀,所以a應該選取石灰水;然后過濾,濾去沉淀;向濾液中加入氫溴酸,目的是除去過量的氫氧化鈣,最后將溶液蒸發濃縮、冷卻結晶、過濾得到CaBr2•6H2O;最后加熱固體得到較純凈的CaBr2;
(1)上述使用的氫溴酸(HBr溶液)的質量分數為26%,若用47%的氫溴酸配制1.2mol/L的氫溴酸的氫溴酸500mL,所需的玻璃儀器除了玻璃棒、量筒、燒杯外,還需要定容的膠頭滴管,配制溶液的500mL容量瓶,故答案為:膠頭滴管、500mL容量瓶;
(2)已知步驟Ⅲ的濾液中不含NH4+,步驟Ⅱ加入的試劑a要除去,Al3+和Fe3+且不能引進新的雜質,則應該選取石灰水溶液;濾液中含有過量的氫氧化鈣,影響溴化鈣制取,所以要除去過量氫氧化鈣,則IV的目的是除去過量的氫氧化鈣,
故答案為:石灰水;除去過量的氫氧化鈣;
(3)從溶液中獲取晶體應該采用蒸發濃縮、冷卻結晶、過濾方法;在晶體表面吸附有雜質,所以洗滌的目的是洗去晶體表面的雜質,減少晶體損失,故答案為:冷卻結晶;洗去晶體表面可溶性雜質,減少晶體損失;
(4)某工業尾氣中含有CO、CO2、SO2氣體,利用如圖2裝置對尾氣進行分步吸收(不轉化)或收集,二氧化硫和二氧化碳都是酸性氧化物,能和堿反應,二氧化硫還具有還原性,CO是不成鹽氧化物,且不溶于水;①因為要分步處理,應該先除去二氧化硫,二氧化硫具有還原性,應該用強氧化性物質除雜,且不能引進新的雜質,所以用高錳酸鉀溶液吸收二氧化硫,故選d;
②然后用堿液吸收二氧化碳,則B吸收二氧化碳,CO不溶于水,且不和酸性高錳酸鉀、堿液反應,所以C中收集到的氣體是CO,
故答案為:CO;
③二氧化碳是酸性氧化物,能和氫氧化鈉反應生成鹽和水,離子反應方程式為CO2+2OH-=CO32-+H2O(或CO2+OH-=HCO3-),
故答案為:CO2+2OH-=CO32-+H2O(或CO2+OH-=HCO3-).
點評 本題考查物質制備,為高頻考點,側重考查學生實驗操作、整體分析能力,需要學生有較扎實的基本知識、基本操作能力,明確各個步驟實驗原理及物質性質是解本題關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 斷裂3NA個碳碳雙鍵時,放出3260kJ的熱量 | |
| B. | 消耗336L O2時,放出6520kJ的熱量 | |
| C. | 轉移30NA個電子時,放出3260kJ的熱量 | |
| D. | 生成3NA個氣態水分子時,放出3260kJ的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
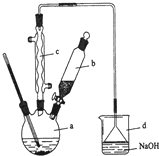 溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:
溴苯是一種化工原料,實驗室合成溴苯的裝置示意圖及有關數據如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸點/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{鐵粉}{→}$
+Br2$\stackrel{鐵粉}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化學 來源: 題型:填空題




查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題



查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  根據圖可判斷可逆反應 A2(g)+3B2 (g)?3C(g)+D(s) 的△H>0 | |
| B. |  圖表示壓強對可逆反應2A (g)+2B (g)?2AB3 (g)的影響,乙的壓強大 | |
| C. |  圖可以表示對某化學平衡體系改變溫度后反應速率隨時間的變化 | |
| D. |  圖④是N2與H2合成氨的能量變化曲線,可確定該反應1 molN2和4mol H2充分反應時放熱一定小于92kJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com