
| 濃度 | c(NH3)(mol/L) | c(O2)(mol/L) | c(NO)(mol/L) |
| 起始 | 0.8 | 1.6 | 0 |
| 第2min | 0.6 | a | 0.2 |
| 第4min | 0.3 | 0.975 | 0.5 |
| 第6min | 0.3 | 0.975 | 0.5 |
| 第8min | 0.7 | 1.475 | 0.1 |
分析 (1)已知氫氣的燃燒熱為285.8 kJ/mol,則①2H2(g)+O2(g)=2H2O(l)△H=-285.8×2 kJ/mol=-571.6kJ/mol,又知②N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ/mol;③N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol,利用蓋斯定律,將①×3-②×2+③×2可得4NH3(g)+5O2(g)?4NO(g)+6 H2O(l),進而可計算反應熱,以此解答;
(2)①反應在第2min到第4min時依據圖表數據可知消耗氨氣0.2mol/L,依據化學反應速率v=$\frac{△c}{△t}$計算氨氣的平均化學反應速率;再根據同一化學反應同一時間段內,各物質的反應速率之比等于計量數之比計算氧氣的平均化學反應速率;
②根據物質的濃度變化判斷反應方向;
③正逆反應速率相等,各組分濃度不變,說明達到平衡狀態,由此分析各選項;
(3)①在CH2=CH2燃料電池中,燃料CH2=CH2作負極,發生失電子的氧化反應;
②CH2=CH2作負極,失電子發生氣化反應;
③根據電解池的工作原理和雙水解原理知識來回答.
解答 解:已知氫氣的燃燒熱為285.8 kJ/mol,則①2H2(g)+O2(g)=2H2O(l)△H=-285.8×2 kJ/mol=-571.6kJ/mol,又知②N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ/mol;③N2(g)+O2(g)=2NO(g)△H=+180.6 kJ/mol,利用蓋斯定律,將①×3-②×2+③×2可得4NH3(g)+5O2(g)?4NO(g)+6 H2O(l),△H=(-571.6kJ/mol)×3+6-(-92.4 kJ/mol)×2+(+180.6 kJ/mol)×2=-1168.8kJ/mol,
故答案為:-1168.8kJ/mol;
(2)①氨氣的平均化學反應速率為v=$\frac{△c}{△t}$=$\frac{(0.6000-0.3000)mol/L}{2min}$=0.015 mol/L.min,同一化學反應同一時間段內,各物質的反應速率之比等于計量數之比,所以氧氣的平均化學反應速率為0.1875mol/L.min.
故答案為:0.1875mol/(L•min);
②通通過圖表知,反應物濃度增大,生成物濃度減小,所以平衡向逆反應方向移動,即向左移動,
A.使用催化劑,平衡不移動,故錯誤;
B.升高溫度,平衡逆向移動,反應物濃度增大,生成物濃度減小,故正確;
C.減小壓強,反應物濃度減小,生成物濃度減小,故錯誤;
D.增加O2的濃度,平衡正向移動,故錯誤;
故選:B;
③A.單位時間內生成n mol NO的同時,等效于消耗n mol NH3的同時生成n mol NH3,故正確;
B.條件一定,混合氣體的平均相對分子質量不再變化,說明正逆反應速率相等,達平衡狀態,故正確;
C.百分含量w(NH3)=w(NO),而不是不變的狀態,不一定平衡,故錯誤;
D.只要反應發生反應速率就符合v(NH3):v(O2):v(NO):v(H2O)=4:5:4:6,所以不一定平衡,故錯誤;
E.若在恒溫恒壓下容積可變的容器中反應,混合氣體的密度不再變化,說明氣體的平均相對分子量不變,反應達平衡狀態,故正確;
故選:ABE;
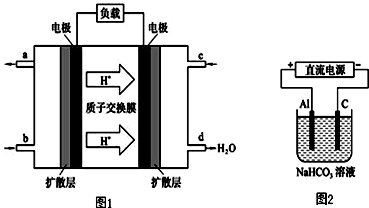
(3)①根據裝置可以知道d處生成大量的水,所以c電極是通入的氧氣,b口通入的物質為C2H4,故答案為:C2H4;
②d處生成大量的水,所以c電極是通入的氧氣,為正極,發生電極反應為:O2+4e-+4H+=2H2O,負極發生氧化反應,電極反應式為:C2H4-12e -+4H2O=2CO2+12H+,
故答案為:C2H4-12e -+4H2O=2CO2+12H+;
③在電解池中,金屬鋁為陽極,發生電極反應:Al-3e-=Al3+,鋁離子會和碳酸氫根離子之間發生雙水解反應生成氫氧化鋁沉淀和二氧化碳,即Al3++3HCO3-=Al(OH)3↓+3CO2↑,溶液逐漸變渾濁,故答案為:Al-3e-=Al3+、Al3++3HCO3-=Al(OH)3↓+3CO2↑.
點評 本題考查了蓋斯定律的應用、反應速率的計算、化學平衡的影響因素、平衡狀態的判斷、圖表數據應用判斷、原電池原理等,難度較大,掌握理解概念和有關原理是解題關鍵.


科目:高中化學 來源: 題型:選擇題
| A. | 二氧化硅與任何酸都不反應 | |
| B. | 二氧化碳通入水玻璃中能得到硅酸沉淀 | |
| C. | 硅的性質很穩定,能以單質形式存在于地殼中 | |
| D. | 二氧化硅溶于水顯酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 油條的制作口訣是“一堿、二礬、三錢鹽”,其中的“堿”是燒堿 | |
| B. | 黑火藥的最優化配方是“一硫二硝三木炭”,其中的“硝”是硝酸鉀 | |
| C. | 過濾操作要領是“一貼二低三靠”,其中“貼”是指濾紙緊貼漏斗的內壁 | |
| D. | “固體需匙或紙槽,一送二豎三彈彈;塊固還是鑷子好,一橫二放三慢豎“.前一個固體一般指粉末狀固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 這種粒子中含有3個質子 | B. | 它的組成可用H3表示 | ||
| C. | 這種粒子中含有3個中子 | D. | 是氫的一種新的同位素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu和Cu2O的物質的量之比為2:1 | |
| B. | 產生的NO在標準狀況下的體積為4.48L | |
| C. | 硝酸的物質的量濃度為2.6mol•L-1 | |
| D. | Cu和Cu2O與硝酸反應后剩余HNO3為0.2mol |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉與水反應比金屬鈉與甲醇反應更劇烈 | |
| B. | 結合H+的能力CH3O-<OH- | |
| C. | 所得到溶液中K=c(CH3O-)×c(CH3OH2+) | |
| D. | 所得到溶液中c(Na+)+c(CH3OH2+)═c(CH3O-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸、純堿、食鹽 | B. | 醋酸、燒堿、生石灰 | ||
| C. | 硝酸、燒堿、膽礬 | D. | 鹽酸、熟石灰、氧化鎂 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com