
【題目】興趣小組同學用下圖所示的裝置來制備溴苯并探究其反應類型。
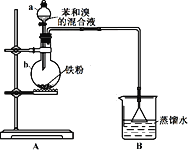
(1)儀器a名稱為_________。B裝置的作用是__________________。
(2)打開a的活塞將苯和溴的混合液滴入b中,反應立即開始。寫出b中發生有機反應的化學方程式______________________。
(3)實驗開始后,首先觀察到b中液體沸騰,且裝置內充滿紅棕色氣體。然后觀察到B中倒扣的漏斗內現象是__________________,說明b中反應有HBr生成,證明制備溴苯的反應是取代反應。
(4)甲同學向B裝置的燒杯中滴入幾滴AgNO3溶液,觀察到_________________,據此進一步確證有HBr生成。乙同學認為甲同學的判斷并不準確,則可能的理由是___________。如果要排除干擾,可在A、B之間增加一個洗氣瓶,內裝試劑可以是__________________(選填序號)。
①NaOH溶液 ②飽和Na2CO3溶液 ③Na2SO3溶液 ④CCl4
(5)純硝基苯是無色、難溶于水,密度比水大,具有苦杏仁味的油狀液體。實驗室制備硝基苯的裝置如圖所示,主要步驟如下(并非正確順序):
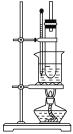
a.配制一定比例的濃硫酸與濃硝酸混合酸,加入反應器中。
b.在50~60 ℃下發生反應,直至反應結束。
c.將用無水CaCl2干燥后的粗硝基苯進行蒸餾,得到純硝基苯。
d.向室溫下的混合酸中逐滴加入一定質量的苯,充分振蕩,混合均勻。
e.除去混合酸后,粗產品依次用蒸餾水和5%NaOH溶液洗滌,最后再用蒸餾水洗滌。
回答下列問題:
①步驟b中的加熱方法為__________,其優點是_________________________________________。
②粗產品用5%NaOH溶液洗滌的目的是_____________。
【答案】分液漏斗 吸收HBr,防止液體倒吸 ![]() +Br2
+Br2![]()
![]() +HBr 出現白霧,液面上升 燒杯中產生淺黃色沉淀 Br2蒸氣進入AgNO3溶液也會產生淺黃色沉淀 ④ 水浴加熱 受熱均勻,易控制溫度 除去粗產品中殘留的酸
+HBr 出現白霧,液面上升 燒杯中產生淺黃色沉淀 Br2蒸氣進入AgNO3溶液也會產生淺黃色沉淀 ④ 水浴加熱 受熱均勻,易控制溫度 除去粗產品中殘留的酸
【解析】
(1) B裝置的作用是吸收HBr,防止液體倒吸;
(2)苯和溴在溴化鐵作催化劑條件下生成溴苯和溴化氫;
(3)反應產生的HBr極易溶于水,氣壓減小,且會與水蒸氣結合成小液滴,有白霧;
(4) AgNO3溶液與HBr和Br2蒸氣均會產生溴化銀沉淀。如果要排除干擾,可在A、B之間增加一個洗氣瓶,除去HBr中的Br2蒸氣;
(5) ①50~60 ℃采用水浴加熱,優點是受熱均勻,易控制溫度;
②5%NaOH溶液洗滌的目的是除去粗產品中殘留的酸。
(1)儀器a名稱為分液漏斗。反應產生的HBr經長導管進入B裝置,B裝置倒置的漏斗具有較大的空間可防止倒吸,故B裝置的作用是吸收HBr,防止液體倒吸;
(2)苯和溴在溴化鐵作催化劑條件下生成溴苯和溴化氫,發生的有機反應的化學方程式為![]() +Br2
+Br2![]()
![]() +HBr;
+HBr;
(3) 反應產生的HBr極易溶于水,會與水蒸氣結合成小液滴,故倒扣的漏斗內現象是出現白霧,液面上升。
(4) B裝置的燒杯中有AgNO3溶液,會產生溴化銀沉淀,故觀察到燒杯中產生淺黃色沉淀。溴易揮發,Br2蒸氣進入AgNO3溶液也會產生淺黃色沉淀,不能確證有HBr生成。如果要排除干擾,可在A、B之間增加一個洗氣瓶,除去HBr中的Br2蒸氣,
①NaOH溶液會與HBr反應,故①錯誤;
②飽和Na2CO3溶液會與HBr反應,故②錯誤;
③Na2SO3溶液會與HBr反應,故③錯誤;
④CCl4不會與HBr反應,且能吸收Br2蒸氣,故④正確;
答案選④;
(5) ①在50~60 ℃下發生反應,故步驟b中的加熱方法為水浴加熱,其優點是受熱均勻,易控制溫度;
②除去混合酸后,粗產品依次用蒸餾水和5%NaOH溶液洗滌,先用蒸餾水除去部分酸,粗產品用5%NaOH溶液洗滌的目的是除去粗產品中殘留的酸。


 小學教材全測系列答案
小學教材全測系列答案科目:高中化學 來源: 題型:
【題目】下列過程中,破壞的作用力相同的是
A.干冰升華和碘升華B.HCl溶于水和NaCl溶于水
C.石英熔化和冰熔化D.NH4Cl受熱分解和HI受熱分解
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向10 mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及導電性變化如圖。下列分析正確的是

A. b~c溶液中所有離子濃度都減小
B. b點溶液pH=7,說明NH4R沒有水解
C. c點溶液中存在c(R-) > c(NH4+)、c(H+)> c(OH-)
D. a~b導電能力增強,說明HR為弱酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CH4、NH3、H2O、HF是第二周期的氫化物,也是生產生活中的重要物質。
(1)在25 ℃、101 kPa時,16 g CH4完全燃燒生成液態水時放出的熱量是890.31 kJ,則CH4的燃燒熱為________________。
(2) NH3和H2O中穩定性較高的是:___________,NH3和PH3中沸點較高的是:__________。
(3)如圖所示組成閉合回路,其中,甲裝置是由CH4、O2和CO2為反應物,稀土金屬材料為電極,以熔融碳酸鹽為電解質形成的原電池;乙裝置中a、b為石墨,b極上有紅色物質析出,CuSO4溶液的體積為200 mL。

①裝置中氣體A為________(填“CH4”或“O2和CO2”),d極上的電極反應式為_______________________________________。
②乙裝置中a極上的電極反應式為___________________。
若在a極產生112 mL(標準狀況)氣體,則甲裝置中消耗CH4________mL(標準狀況),乙裝置中所得溶液的pH=________(忽略電解前后溶液體積變化)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于物質分類的說法不正確的是
A. 金剛石、紅磷都屬于單質 B. 漂白粉、玻璃都屬于混合物
C. 氯化銨、氨氣都屬于電解質 D. 生鐵、青銅都屬于合金
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W為原子序數依次增大的四種短周期元素,其中Z為金屬元素,X、W為同一主族元素。X、Z、W形成的最高價氧化物分別為甲、乙、丙。x、y2、z、w分別為X、Y、Z、W的單質,丁是化合物。其轉化關系如圖所示,下列判斷錯誤的是( )

A. 反應①、②、③都屬于氧化還原反應 B. X、Y、Z、W四種元素中,Y的原子半徑最小
C. Na著火時,可用甲撲滅 D. 一定條件下,x與甲反應生成丁
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼、鎂及其化合物在工農業生產中應用廣泛。
I.已知硼鎂礦主要成分為Mg2B2O5H2O,硼砂的化學式為Na2B4O710H2O。一種利用硼鎂礦制取金屬鎂及粗硼的工藝流程如下所示:

(1)硼砂中B元素的化合價為_______,將硼砂溶于熱水后,用硫酸調節溶液的pH為2~3以制取H3BO3,該反應的離子方程式為____________________。X為H3BO3晶體加熱脫水的產物,其與Mg反應制取粗硼的化學方程式為_____________。
(2)由MgCl2·7H2O制備MgCl2時,需要在HC1氛圍中加熱,其目的是________。
(3)鎂-H2O2酸性燃料電池的反應原理為Mg+H2O2+2H+==Mg2++2H2O,常溫下,若起始電解質溶液pH=1,則pH=2時,電解質溶液中所含Mg2+的物質的量濃度為_____________mol·L-1。已知該溫度下,Ksp[Mg(OH)2]=5.6×10-12,當電解質溶液的pH=6時,_______(填“有”或“無”)Mg(OH)2沉淀析出。(忽略反應過程中溶液的體積變化)
II.工業上可用納米MgH2和LiBH4組成的體系儲放氫,如圖所示。

(4)寫出放氫過程中發生反應的化學方程式:____________。
III. MgO漿液是一種高活性的脫硫劑,常用于脫除煙氣中的SO2,發生的主要反應如下:
①Mg(OH)2+SO2===MgSO3+H2O
②MgSO3+SO2+H2O===Mg(HSO3)2
③Mg(HSO3)2+Mg(OH)2===2MgSO3+2H2O
④2MgSO3+O2===2MgSO4
已知25℃時,Kap(MgSO3)=3.86×10-3,Kap(CaSO3)=3.1×10-7。
(5)其他條件相同時,鎂基和鈣基的脫硫效率與液、氣摩爾流量比的變化情況如圖所示。鎂基的脫硫效率總比鈣基的大,除生成的MgSO4具有良好的水溶性外,還因為_____________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.恒溫恒容下,將2molA氣體和2molB氣體通入體積為2L的密閉容器中發生如下反應:2A(g)+B(g) xC(g)+2D(s),2 min時反應達到平衡狀態,此時剩余1.2 mol B,并測得C的濃度為1.2 mol·L-1。
(1)從開始反應至達到平衡狀態,生成C的平均反應速率為____mol·L-1·s-1。
(2)x=____。
(3)下列各項可作為該反應達到平衡狀態的標志的是____。
A 壓強不再變化 B υ(A)正=2υ(B)逆
C 氣體密度不再變化 D A的百分含量保持不變
E A的消耗速率與C的消耗速率之比為2:1
Ⅱ.某魚雷采用 Al-Ag2O 動力電池,以溶解有KOH 的流動海水為電解液,電池總反應為:2Al+ 3Ag2O + 2KOH = 6Ag + 2KAlO2 + H2O。試回答下列問題:
(1)Ag2O 為電池的____極(填“負”或“正”)其電極反應式為______。
(2)電子由_____極經外電路流向___極(填“Ag2O”或“Al”),當有 1mol電子流經外電路時,負極質量減少___g。
(3)溶液中的 OH-向____極遷移(填“Ag2O”或“Al”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com