
分析 (1)用氧化物表示物質的組成時,要按照:活潑金屬氧化物•不活潑金屬氧化物•SiO2•H2O的順序來書寫;
(2)鎂能在二氧化碳中燃燒;
(3)在NaHSO4溶液中滴加Ba(OH2)溶液至溶液呈中性,反應生成硫酸鋇、硫酸鈉和水;
(4)①煅燒黃鐵礦生成氧化鐵和二氧化硫;
②亞鐵離子的還原性大于溴離子,氯氣不足時亞鐵離子優先反應.
解答 解:(1)用氧化物表示物質的組成時,要按照:活潑金屬氧化物•不活潑金屬氧化物•SiO2•H2O的順序,故NaAl(SiO3)2的組成可以表示為:Na2O•Al2O3•4SiO2,
故答案為:Na2O•Al2O3•4SiO2;
(2)鎂能在二氧化碳中燃燒,化學方程式為:2Mg+CO2$\frac{\underline{\;點燃\;}}{\;}$2MgO+C,
故答案為:2Mg+CO2$\frac{\underline{\;點燃\;}}{\;}$2MgO+C;
(3)在NaHSO4溶液中滴加Ba(OH2)溶液至溶液呈中性,反應生成硫酸鋇、硫酸鈉和水,離子方程式:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓;
故答案為:Ba2++2OH-+2H++SO42-═2H2O+BaSO4↓;
(4)①煅燒黃鐵礦生成氧化鐵和二氧化硫,化學方程式為:4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2,
故答案為:4FeS2+11O2$\frac{\underline{\;高溫\;}}{\;}$2Fe2O3+8SO2;
②向FeBr2中通入等量Cl2,亞鐵離子優先反應,然后部分溴離子被氯氣氧化,反應的離子方程式為:2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl-,
故答案為:2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl-.
點評 本題考查了化學方程式的書寫、離子方程式書寫,題目難度不大,明確發生反應的實質為解答關鍵,注意熟練掌握離子方程式的書寫原則,試題培養了學生的分析能力及靈活應用能力.


 星級口算天天練系列答案
星級口算天天練系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1:2 | B. | 1:4 | C. | 2:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
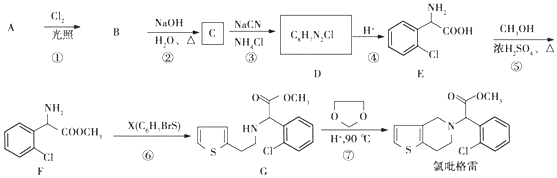
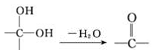 ;②
;②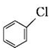 中氯原子較難水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$
中氯原子較難水解;③RCHO$→_{NH_{4}Cl}^{NaCN}$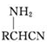
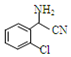 ;C分子中最多有14個原子共平面.
;C分子中最多有14個原子共平面.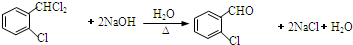 .
.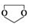 ,需要經歷的反應類型有②①③④③(填寫編號).①加成反應 ②消去反應 ③取代反應 ④氧化反應 ⑤還原反應,寫出制備化合物
,需要經歷的反應類型有②①③④③(填寫編號).①加成反應 ②消去反應 ③取代反應 ④氧化反應 ⑤還原反應,寫出制備化合物 的最后一步反應HOCH2CH2OH+HCHO$\stackrel{酸}{→}$
的最后一步反應HOCH2CH2OH+HCHO$\stackrel{酸}{→}$ .
.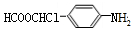 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 制備氯氣時嚴格檢查裝置的氣密性,并設置尾氣吸收裝置 | |
| B. | 稀釋濃硫酸時,將水倒入濃硫酸中,使用玻璃棒不斷攪拌 | |
| C. | 在敞口容器中進行銅與濃硝酸的反應,并觀察生成的氣體 | |
| D. | 向一支試管中加入少量水,向其中投入一塊黃豆大小的鈉 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com