
如圖:橫坐標為溶液的pH,縱坐標為Zn2+或[Zn(OH)4]2-物質的量濃度的對數,回答下列問題。
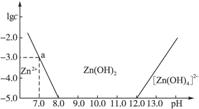
(1)往ZnCl2溶液中加入足量的氫氧化鈉溶液,反應的離子方程式可表示為____________。
(2)從圖中數據計算可得Zn(OH)2的溶度積Ksp=____________。
(3)某廢液中含Zn2+,為提取Zn2+可以控制溶液pH的范圍是____________。
科目:高中化學 來源: 題型:閱讀理解
 (2011?惠州模擬)鐵、銅都是人類最早使用的金屬,它們的單質及化合物應用非常廣泛.
(2011?惠州模擬)鐵、銅都是人類最早使用的金屬,它們的單質及化合物應用非常廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
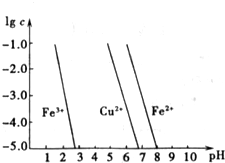 鐵、銅都是人類最早使用的金屬,它們的單質及化合物應用非常廣泛.
鐵、銅都是人類最早使用的金屬,它們的單質及化合物應用非常廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:
(10分)如圖橫坐標為溶液的pH值,縱坐標為Zn2+ 離子或Zn(OH)42-離子(配離子)物質的量濃度的對數,回答下列問題.

(1)往ZnCl2溶液中加入足量的氫氧化鈉溶液,反應的離子方程式可表示為 。
(2)從圖中數據計算可得Zn(OH)2的溶度積(Ksp)= 。
(3)某廢液中含Zn2+ 離子,為提取Zn2+ 離子可以控制溶液中pH值的范圍是 。
(4)往1L 1.00 mol?L-1 ZnCl2溶液中加入NaOH固體至pH=6,需NaOH mol (精確到小數點后2位)。
(5)25℃時,PbCl2固體在鹽酸中的溶解度如下:
c(HCl)/ (mol?L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
103 c(PbCl2)/ (mol?L-1) | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根據上表數據判斷下列說法正確的是 。
![]() A.隨著鹽酸濃度的增大,PbCl2固體的溶解度先變小后又變大
A.隨著鹽酸濃度的增大,PbCl2固體的溶解度先變小后又變大
![]() B.PbCl2固體在0.50 mol?L-1鹽酸中的溶解度小于在純水中的溶解度
B.PbCl2固體在0.50 mol?L-1鹽酸中的溶解度小于在純水中的溶解度
![]() C.PbCl2能與濃鹽酸反應生成一種難電離的陰離子(配離子)
C.PbCl2能與濃鹽酸反應生成一種難電離的陰離子(配離子)
![]() D.PbCl2固體可溶于飽和食鹽水
D.PbCl2固體可溶于飽和食鹽水
查看答案和解析>>
科目:高中化學 來源:2011年廣東省惠州市高考化學模擬試卷(解析版) 題型:填空題
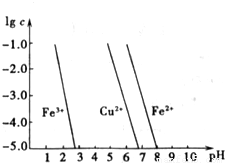
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com