
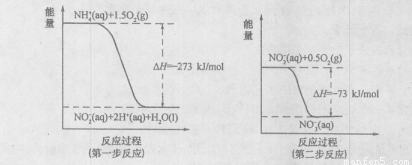
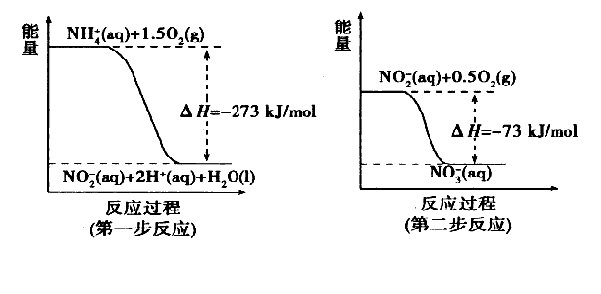
(I某氮肥廠氨氮廢水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+經(jīng)過兩步反應被氧化成NO3-,兩步反應的能量變化示意圖如下:
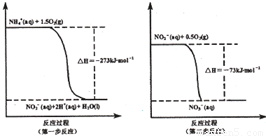
(1)1 mo1NH4+(aq)全部氧化成NO3-(aq)的熱化學方程式是 _ 。
(2)在一定條件下,向廢水中加入CH3OH,將HNO3還原成 N2,若該反應消耗32gCH3OH轉(zhuǎn)移6mol電子,則參加反應的還原劑和氧化劑的物質(zhì)的量之比是_ 。
(B)超音速飛機在平流層飛行時,尾氣中的NO會破壞臭氧層。科學家正在研究利用催化技術(shù)
將尾氣中的NO和CO轉(zhuǎn)變成CO2和N2,化學方程式如下:2NO十2CO 2CO2+ N2 △H
2CO2+ N2 △H
某溫度下用氣體傳感器測得不同的時間的NO和CO濃度如下表:
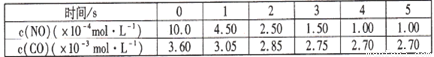
請回答下列問題(均不考慮溫度變化對催化劑催化效率的影響):
(1)在上述條件下反應能夠自發(fā)進行,則反應的△H 0(填寫“>”、“<”、“=”)
(2)在該溫度下,反應的平衡常數(shù)K= (只寫出計算結(jié)果);
(3)某同學設(shè)計了三組實驗,分別驗證溫度、催化劑比表面積對化學反應速率的影響規(guī)律,
部分實驗條件如下表:

該同學畫出了表中三個實驗條件下,混合氣體中NO濃度隨時間變化的趨勢曲線圖,請在圖上標明各條曲線的實驗編號;
(I)(1)NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)
△H=-346kJ·mol-1
(2)5:6
(Ⅱ)(1)<
(2)5000
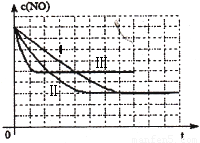
(3)見圖
【解析】
試題分析:(I)(1)NH4+(aq)+2O2(g)=2H+(aq)+NO3-(aq)+H2O(l)
1 mo1NH4+(aq)全部氧化成NO3-(aq)的熱化學方程式中△H為第一步反應和第二部反應之和即為:-346kJ·mol-1;(2)32gCH3OH的物質(zhì)的量為1mol,轉(zhuǎn)移電子6mol表示氧化劑HNO3得到6mol電子,由于HNO3中N元素有+5價將為N2中的0價因此需要1.2molHNO3參與反應。因此參加反應的還原劑CH3OH和氧化劑HNO3的物質(zhì)的量之比是5:6。
(Ⅱ)(1)此反應為氣體體積縮小的反應△S<0,由于反應能夠自發(fā)進行因此△G=△H-T△S<0,因此
△H<0
(2) 2NO + 2CO  2CO2 +
N2
2CO2 +
N2
始:10.0×10-4 3.6×10-3 0 0
變:9.00×10-4 9.00×10-4 9.00×10-4 4.50×10-4
終:1.00×10-4 2.7×10-3 9.00×10-4 4.50×10-4
由公式計算可得K=5000
(3)Ⅱ?qū)Ρ菼增加了催化劑的比表面積,催化劑只會縮短達到平衡的時間并不影響平衡的移動;Ⅲ對比Ⅱ提高了反應的溫度,平衡向吸熱方向移動,即向逆反應方向移動c(NO)提高。
考點:熱化學方程式和化學平衡的有關(guān)分析和計算。


科目:高中化學 來源:2010-2011學年新疆烏魯木齊地區(qū)高三第三次診斷性測試(理綜)化學部分 題型:填空題
(I)某氮肥廠氨氮廢水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+經(jīng)過兩步反應被氧化成NO3-,兩步反應的能量變化示意圖如下:
 [來源:學,科,網(wǎng)]
[來源:學,科,網(wǎng)]
(1)1molNH4+(aq)全部氧化成NO3-(aq)的熱化學方程式是 。
(2)在一定條件下,向廢水中加入CH3OH,將HNO3還原成N2,若該反應消耗32gCH3OH轉(zhuǎn)移6mol電子,則參加反應的還原劑和氧化劑的物質(zhì)的量之比是 。
(Ⅱ)超音速飛機在平流層飛行時,尾氣中的NO會破壞臭氧層。科學家正在研究利用催化技術(shù)將尾氣中的NO和CO轉(zhuǎn)變成CO2和N2,化學方程式如下:
2NO+2CO 2CO2+N2
△H
2CO2+N2
△H
某溫度下用氣體傳感器測得不同的時間的NO和CO濃度如下表:
|
時間/s |
0 |
1 |
2 |
3 |
4 |
5 |
|
C(NO)(×10-4mol·L-1) |
10.0 |
4.50 |
2.50 |
1.50 |
1.00 |
1.00 |
|
C(CO)(×10-3mol·L-1) |
3.60 |
3.05 |
2.85 |
2.75 |
2.70 |
2.70 |
請回答下列問題(均不考慮溫度變化對催化劑催化效率的影響):
(1)在上述條件下反應能夠自發(fā)進行,則反應的△H 0(填寫“>”、“<”、“=”)
(2)前2s內(nèi)的平均反應速率v(N2)= ;
(3)在該溫度下,反應的平衡常數(shù)K= (只寫出計算結(jié)果);
(4)某同學設(shè)計了三組實驗,分別驗證溫度、催化劑比表面積對化學反應速率的影響規(guī)律,部分實驗條件如下表:
|
實驗編號 |
T/℃ |
NO初始濃度/mol·L-1 |
CO初始濃度/mol·L-1 |
催化劑的比表面積/m2·g-1 |
|
I |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
II |
280 |
1.20×10-3 |
5.80×10-3 |
124 |
|
III |
350 |
1.20×10-3[來源:學.科.網(wǎng)] |
5.80×10-3 |
124 |
該同學畫出了表中三個實驗條件下,混合氣體中NO濃度隨時間變化的趨勢曲線圖,請在圖上標明各條曲線的實驗編號;
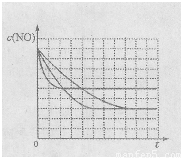
(5)有人認為:催化劑比表面積增大,會提高NO和CO的反應效率,從而使污染物NO和CO的轉(zhuǎn)化率提高。請用化學基本理論對此觀點進行評價: 。
查看答案和解析>>
科目:高中化學 來源:北京高考真題 題型:填空題
查看答案和解析>>
科目:高中化學 來源:模擬題 題型:填空題


 2CO2(g)+N2(g) 在某溫度T1℃下,2L密閉容器中充入NO 、CO各0.4mol,測得不同時間的NO和CO物質(zhì)的量如下表:
2CO2(g)+N2(g) 在某溫度T1℃下,2L密閉容器中充入NO 、CO各0.4mol,測得不同時間的NO和CO物質(zhì)的量如下表: 
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
(I)某氮肥廠氨氮廢水中的氮元素多以NH4+和NH3·H2O的形式存在。在微生物作用下,NH4+經(jīng)過兩步反應被氧化成NO3-,兩步反應的能量變化示意圖如下:
(1)1molNH4+(aq)全部氧化成NO3-(aq)的熱化學方程式是 。
(2)在一定條件下,向廢水中加入CH3OH,將HNO3還原成N2,若該反應消耗32gCH3OH轉(zhuǎn)移6mol電子,則參加反應的還原劑和氧化劑的物質(zhì)的量之比是 。
(Ⅱ)超音速飛機在平流層飛行時,尾氣中的NO會破壞臭氧層。科學家正在研究利用催化技術(shù)將尾氣中的NO和CO轉(zhuǎn)變成CO2和N2,化學方程式如下:
2NO+2CO![]() 2CO2+N2 △H
2CO2+N2 △H
某溫度下用氣體傳感器測得不同的時間的NO和CO濃度如下表:
| 時間/s | 0 | 1 | 2 | 3 | 4 | 5 |
| C(NO)(×10-4mol·L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| C(CO)(×10-3mol·L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
請回答下列問題(均不考慮溫度變化對催化劑催化效率的影響):
(1)在上述條件下反應能夠自發(fā)進行,則反應的△H 0(填寫“>”、“<”、“=”)
(2)前2s內(nèi)的平均反應速率v(N2)= ;
(3)在該溫度下,反應的平衡常數(shù)K= (只寫出計算結(jié)果);
(4)某同學設(shè)計了三組實驗,分別驗證溫度、催化劑比表面積對化學反應速率的影響規(guī)律,部分實驗條件如下表:
| 實驗編號 | T/℃ | NO初始濃度/mol·L-1 | CO初始濃度/mol·L-1 | 催化劑的比表面積/m2·g-1 |
| I | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| II | 280 | 1.20×10-3 | 5.80×10-3 | 124 |
| III | 350 | 1.20×10-3[來源:學.科.網(wǎng)] | 5.80×10-3 | 124 |
該同學畫出了表中三個實驗條件下,混合氣體中NO濃度隨時間變化的趨勢曲線圖,請在圖上標明各條曲線的實驗編號;
(5)有人認為:催化劑比表面積增大,會提高NO和CO的反應效率,從而使污染物NO和CO的轉(zhuǎn)化率提高。請用化學基本理論對此觀點進行評價: 。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com