
將一定質量的Mg和Al的混合物投入500 mL稀硫酸中,固體全部溶解并產生氣體,待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示。則下列說法正確的是 ( ) 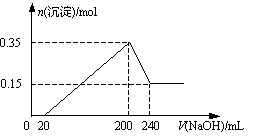
| A.Mg和Al的總質量為8 g |
| B.硫酸的物質的量濃度為5 mol/L |
| C.NaOH溶液的物質的量濃度為5 mol/L |
| D.生成的H2在標準狀況下的體積為11.2 L |
C
解析試題分析:鎂、鋁分別與稀硫酸反應生成硫酸鎂、硫酸鋁以及氫氣。根據圖像可知,加入氫氧化鈉溶液后并沒有立即生成白色沉淀,這說明稀硫酸的是過量的。即氫氧化鈉首先和過量的稀硫酸反應,然后在分別與硫酸鎂、硫酸鋁反應生成氫氧化鎂、氫氧化鋁沉淀。當氫氧化鈉溶液過量時,氫氧化鋁又溶解在氫氧化鈉溶液中,生成偏鋁酸鈉和水。根據圖像可知,與氫氧化鋁反應的氫氧化鈉水240ml-200mol=40ml。而沉淀減少了0.35mol-0.15mol=0.20mol,這說明氫氧化鋁是0.2mol,氫氧化鎂是0.15mol,所以鎂和鋁的總的質量是0.15mol×24g/mol+0.2mol×27g/mol=9g,和稀硫酸反應生成的氫氣是0.3mol+0.15mol=0.45mol,標準狀況下的體積是10.08L。根據反應Al(OH)3+NaOH=NaAlO2+2H2O可知,氫氧化鈉的物質的量濃度是0.2mol÷0.04L=5.0mol/L。則沉淀最大值是生成硫酸鈉是(0.2L×5mol/L)÷2=0.5mol,所以稀硫酸的濃度是0.5mol÷0.5L=1.0mol/L,答案選C。
考點:考查鎂、鋁與稀硫酸以及氫氧化鈉反應的有關計算和圖像識別
點評:該題是高考中的常見題型,屬于中等難度的試題。試題綜合性強,在注重對學生基礎知識鞏固與訓練的同時,側重對學生能力培養與解題方法的指導與訓練。該題的關鍵是明確反應的原理,然后再結合圖像靈活運用即可,有利于培養學生的邏輯推理能力。


科目:高中化學 來源: 題型:
 將一定質量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固體全部溶解并產生氣體0待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示.則下列說法正確的是( )
將一定質量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固體全部溶解并產生氣體0待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示.則下列說法正確的是( )查看答案和解析>>
科目:高中化學 來源: 題型:
 (2009?長春一模)將一定質量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示.則下列說法正確的是( )
(2009?長春一模)將一定質量的Mg和Al的混合物投入1mol?L-1500mL稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示.則下列說法正確的是( )查看答案和解析>>
科目:高中化學 來源: 題型:
 將一定質量的Mg和Al混合物投入500mL 稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示.則下列說法正確的是( )
將一定質量的Mg和Al混合物投入500mL 稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示.則下列說法正確的是( )查看答案和解析>>
科目:高中化學 來源: 題型:
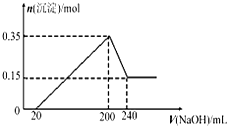 將一定質量的Mg和Al的混合物投入500mL稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示,則下列說法不正確的是( )
將一定質量的Mg和Al的混合物投入500mL稀硫酸中,固體全部溶解并產生氣體.待反應完全后,向所得溶液中加入NaOH溶液,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示,則下列說法不正確的是( )| A、Mg和Al的總質量為9g | B、生成的H2在標準狀況下的體積為11.2L | C、NaOH溶液的物質的量濃度為5mol/L | D、硫酸的物質的量濃度為1mol/L |
查看答案和解析>>
科目:高中化學 來源:2015屆天津市高一上學期期末考試化學試卷(解析版) 題型:選擇題
將一定質量的Mg和Al混合物投入到200mL稀硫酸中,固體全部溶解后,向所得溶液中滴加NaOH溶液至過量,生成沉淀的物質的量與加入NaOH溶液的體積關系如圖所示。則下列說法不正確的是

A.Mg和Al的總質量為9g
B.最初20mLNaOH溶液用于中和過量的稀硫酸
C.NaOH溶液物質的量濃度為5mol·L-1
D.生成的氫氣在標準狀況下的體積為11.2L
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com