
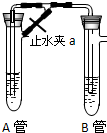 為了制得較純凈的Fe(OH)2,甲乙兩同學分別用下面兩種方法制得白色的Fe(OH)2沉淀.
為了制得較純凈的Fe(OH)2,甲乙兩同學分別用下面兩種方法制得白色的Fe(OH)2沉淀.

 陽光課堂課時作業系列答案
陽光課堂課時作業系列答案科目:高中化學 來源: 題型:
 為了制得較純凈的Fe(OH)2,甲乙兩同學分別用下面兩種方法制得白色的Fe(OH)2沉淀.
為了制得較純凈的Fe(OH)2,甲乙兩同學分別用下面兩種方法制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化學 來源: 題型:
 為了制得較純凈的Fe(OH)2,甲乙兩同學分別用下面兩種方法制得白色的Fe(OH)2沉淀.
為了制得較純凈的Fe(OH)2,甲乙兩同學分別用下面兩種方法制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
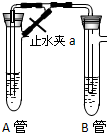
查看答案和解析>>
科目:高中化學 來源:2012-2013學年甘肅省天水市秦州中學高一(上)期中化學試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com