
| A. | 開始加入合金的質量可能為3.0 g | |
| B. | 參加反應的硝酸的物質的量是0.1 mol | |
| C. | 完全生成沉淀時消耗NaOH溶液的體積為100 mL | |
| D. | 溶解合金時收集到NO氣體的體積為2.24 L |
分析 將一定量的鎂和銅組成的混合物加入到稀HNO3中,金屬完全溶解(假設反應中還原產物只有NO),發生反應:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反應后的溶液中加入過量的3mol/L NaOH溶液至沉淀完全,發生反應:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀為氫氧化鎂和氫氧化銅,生成沉淀的質量比原合金的質量增加5.1g,則氫氧化鎂和氫氧化銅含有氫氧根的質量為5.1g,氫氧根的物質的量為$\frac{5.1g}{17g/mol}$=0.3mol,根據電子轉移守恒,則鎂和銅的總的物質的量為0.15mol,
A.根據電子注意計算金屬總物質的量,金屬的總質量與金屬的含量有關,假定全為鎂、全為銅計算確定金屬的質量范圍;
B.根據方程式可知參加反應的n反應(HNO3)=$\frac{8}{3}$n(金屬);
C.n(NaOH)=n(OH-),根據V=$\frac{n}{c}$計算加入的氫氧溶液的體積;
D.根據電子轉移守恒計算n(NO),然后計算出標況下一氧化氮的體積.
解答 將一定量的鎂和銅組成的混合物加入到稀HNO3中,金屬完全溶解(假設反應中還原產物只有NO),發生反應:3Mg+8HNO3(稀)=3Mg(NO3)2+2NO↑+4H2O、3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,向反應后的溶液中加入過量的3mol/L NaOH溶液至沉淀完全,發生反應:Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3,沉淀為氫氧化鎂和氫氧化銅,生成沉淀的質量比原合金的質量增加5.1g,則氫氧化鎂和氫氧化銅含有氫氧根的質量為5.1g,氫氧根的物質的量為$\frac{5.1g}{17g/mol}$=0.3mol,根據電子轉移守恒,則鎂和銅的總的物質的量為0.15mol,
A.根據反應方程式Mg(NO3)2+2NaOH=Mg(OH)2↓+2NaNO3、Cu(NO3)2+2NaOH=Cu(OH)2↓+2NaNO3可知,鎂和銅的總的物質的量為銅離子物質的量的一半,即:$\frac{0.3mol}{2}$=0.15mol,假定全為鎂,金屬質量為0.15mol×24g/mol=3.6g,若全為銅,金屬質量為:0.15mol×64g/mol=9.6g,所以參加反應的金屬的總質量(m)范圍為:3.6g<m<9.6g,則金屬質量不可能為3.0g,故A錯誤;
B.根據方程式可知參加反應的n反應(HNO3)=$\frac{8}{3}$n(金屬)=$\frac{8}{3}$×0.15mol=0.4mol,故B錯誤;
C.反應消耗氫氧化鈉的物質的量為:n(NaOH)=n(OH-)=0.3mol,則加入的氫氧化鈉溶液的體積為:V=$\frac{0.3mol}{3mol/L}$=0.1L=100mL,故C正確;
D.金屬的物質的量為0.15mol,完全反應失去0.15mol×2=0.3mol電子,根據電子轉移守恒,生成一氧化氮的物質的量為:n(NO)=$\frac{0.3mol}{5-2}$=0.1mol,在標準狀況下0.1molNO的體積為2.24L,故D錯誤;
故選C.
點評 本題主要考查混合物有關計算,涉及鎂銅與硝酸反應、生成的鹽與氫氧化鈉反應,側重于學生的得失電子守恒、質量守恒等綜合運用和解決復雜問題的能力的考查,是一道考查能力的好題,難度中等.


科目:高中化學 來源: 題型:解答題
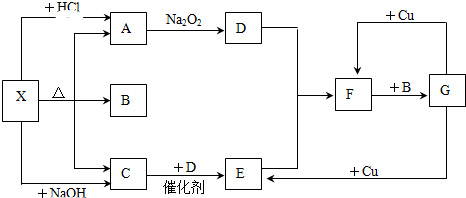
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
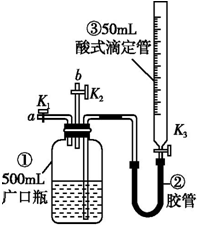 某活動小組利用如圖裝置驗證NO的還原性及探究工業生產硝酸的原理.
某活動小組利用如圖裝置驗證NO的還原性及探究工業生產硝酸的原理.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
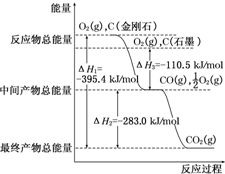 (1)家用液化氣中主要成分之一是丁烷(C4H10).當1g丁烷完全燃燒并生成CO2和液態水時,放出熱量50kJ.試寫出丁烷燃燒反應的熱化學方程式
(1)家用液化氣中主要成分之一是丁烷(C4H10).當1g丁烷完全燃燒并生成CO2和液態水時,放出熱量50kJ.試寫出丁烷燃燒反應的熱化學方程式查看答案和解析>>
科目:高中化學 來源: 題型:解答題
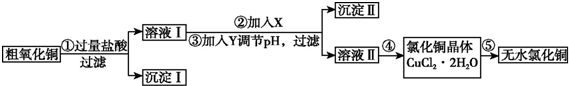
| 氫氧化物開始沉淀時的pH | 氫氧化物沉淀完全時的pH | |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的試劑:a.NaOH b.H2O2 c.Na2CO3 d.CuO | ||
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
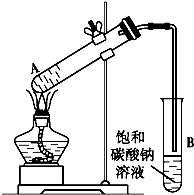 乙酸乙酯是重要的化工原料.實驗室合成乙酸乙酯的裝置如下圖所示.
乙酸乙酯是重要的化工原料.實驗室合成乙酸乙酯的裝置如下圖所示.| 乙酸 | 乙醇 | 乙酸乙酯 | C2H5OC2H5(乙醚) | |
| 沸點/℃ | 118 | 78.3 | 77.1 | 34.5 |
| 溶解性 | 易溶于水 | 極易溶于水 | 與乙醚混溶 | 微溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
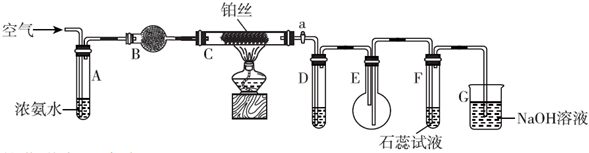
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
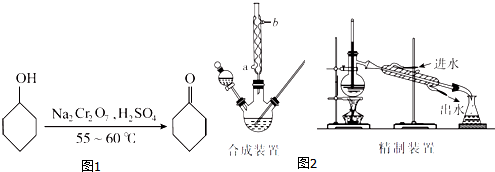
| 物質 | 相對分子質量 | 沸點(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 環己醇 | 100 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 環己酮 | 98 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 18 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
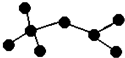 如圖是辛烷的一種結構M(只畫出了碳架,沒有畫出氫原子),回答下列問題:
如圖是辛烷的一種結構M(只畫出了碳架,沒有畫出氫原子),回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com