
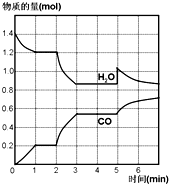
 在一容積為2L的密閉容器中,高溫下發生下列反應:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物質的量(mol)隨時間(min)的變化曲線如圖所示:
在一容積為2L的密閉容器中,高溫下發生下列反應:C(s)+H2O(g)?CO(g)+H2(g),其中H2O、CO的物質的量(mol)隨時間(min)的變化曲線如圖所示:分析 (1)根據v(CO)=$\frac{\frac{△n}{V}}{△t}$計算1min內υ(CO);
(2)圖象分析物質水、一氧化碳物質的量不變的時間段為平衡狀態;
(3)反應進行至2min時,根據圖象知,相同時間內,水和一氧化碳的物質的量變化量大于0-1min內,說明反應速率增大,根據壓強和溫度對反應速率、化學平衡的影響分析;
(4)反應至第5min時,CO的物質的量不變,水的物質的量增大,說明改變的量是水的物質的量.
解答 解:(1)根據他可知,1min時CO的物質的量變化為0.2mol,1min內υ(CO)=$\frac{\frac{0.2mol}{2L}}{1min}$=0.1mol/(L•min),
故答案為:0.1mol/(L•min);
(2)反應達到平衡狀態時,正逆反應速率相等,平衡時各種物質的物質的量、濃度、含量等不再發生變化,以及由此衍生的其它量不變,可由此判斷1~2 min、3~5 min時間段反應達到平衡狀態,
故答案為:1~2 min、3~5 min;
(3)反應進行至2min時,根據圖象知,升高溫度后CO物質的量增大,說明平衡正向進行,正反應為吸熱反應,則逆反應為放熱反應,
故答案為:放;
(4)反應至第5min時,CO的物質的量不變,水的物質的量增大,說明改變的量是增加水的物質的量,隨反應進行水蒸氣減小,一氧化碳增大,平衡正向進行;
A.C是固體,增加C的量不影響化學平衡,故A錯誤;
B.增加了水蒸氣,5min時CO的物質的量不變,水的物質的量增大,與圖象變化一致,故B正確;
C.反應是吸熱反應,降低了溫度平衡逆向進行,水的物質的量增大、CO的物質的量減小,與圖象變化不一致,故C錯誤;
D.增加了壓強,平衡逆向進行,水的物質的量增大、CO的物質的量減小,與圖象變化不一致,故D錯誤;
故答案為:B.
點評 本題考查很配合的計算,題目難度中等,涉及化學平衡狀態的判斷、外界條件對化學平衡的影響,明確化學平衡狀態的判斷依據、溫度和物質的濃度對化學平衡的影響即可解答,注意降低溫度時,無論是吸熱反應還是放熱反應,都降低反應速率,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氮的化合物在生產生活中廣泛存在.
氮的化合物在生產生活中廣泛存在. .可通過反應NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制備氯胺,已知部分化學鍵的鍵能如下表所示(假定不同物質中同種化學鍵的鍵能一樣),則上述反應的△H=+11.3kJ•mol-1.
.可通過反應NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制備氯胺,已知部分化學鍵的鍵能如下表所示(假定不同物質中同種化學鍵的鍵能一樣),則上述反應的△H=+11.3kJ•mol-1.| 化學鍵 | 鍵能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 操作及現象 | 結論 |
| A | 將0.1mol•L-1氨水稀釋成0.01mol•L-1,測得pH由11.1變成10.6 | 稀釋后NH3•H2O的電離程度減小 |
| B | 將銅片與鋅片用導線連接后,插入稀硫酸中,銅片上有氣泡產生 | 在鋅的作用下,銅與硫酸反應產生氫氣 |
| C | 向25mL冷水和沸水中分別滴入5滴FeCl3飽和溶液,前者為黃色,后者為紅褐色 | 溫度升高,Fe3+的水解程度增大 |
| D | 將固體CaSO4加入Na2CO3飽和溶液中,一段時間后,檢驗固體成分為CaCO3 | 同溫下溶解度:CaSO4<CaCO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硫酸銅、二氧化硫都是電解質 | |
| B. | Fe(OH)3膠體無色、透明,能發生丁達爾現象 | |
| C. | H2、SO2、CO2三種氣體都可用濃硫酸干燥 | |
| D. | SiO2既能和氫氧化鈉溶液反應也能和氨氟酸反應,所以是兩性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com