
【題目】元素周期表中第ⅦA族元素的單質(zhì)及其化合物的用途廣泛。
(1)與氯元素同族的短周期元素的原子核外電子排布式為___。
(2)能作為氯、溴、碘元素非金屬性(原子得電子能力)遞變規(guī)律的判斷依據(jù)是___ (填序號(hào))。
a.Cl2、Br2、I2的熔點(diǎn) b.Cl2、Br2、I2的氧化性
c.HCl、HBr、HI的熱穩(wěn)定性 d.HCl、HBr、HI的酸性
(3)工業(yè)上,通過(guò)如圖轉(zhuǎn)化可制得KClO3晶體:
NaCl溶液![]() NaClO3溶液
NaClO3溶液![]() KClO3晶體
KClO3晶體
II中轉(zhuǎn)化的基本反應(yīng)類型是___,該反應(yīng)過(guò)程能析出KClO3晶體而無(wú)其它晶體析出的原因是___。
(4)晶體硅(熔點(diǎn)1410℃)是良好的半導(dǎo)體材料;四氯化硅熔點(diǎn)-70℃,沸點(diǎn)57.6℃;由粗硅制純硅過(guò)程如圖:
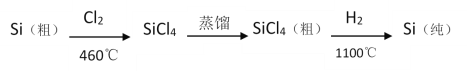
寫出SiCl4的電子式:___;在上述由SiCl4制純硅的反應(yīng)中,測(cè)得生成7kg純硅需吸收akJ熱量,寫出該反應(yīng)的熱化學(xué)方程式:___。
(5)ClO2是常用于水的凈化,工業(yè)上可用Cl2氧化NaClO2溶液制取ClO2。寫出該反應(yīng)的離子方程式,并用單線橋標(biāo)出電子轉(zhuǎn)移的方向和數(shù)目___。
【答案】1s22s22p5 bc 復(fù)分解反應(yīng) 室溫下,氯酸鉀在水中溶解度明顯小于其他晶體  SiCl4(g)+2H2(g)=Si(s)+4HCl(g)-0.004akJ
SiCl4(g)+2H2(g)=Si(s)+4HCl(g)-0.004akJ 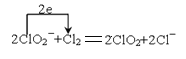
【解析】
(1)與氯元素同族的短周期元素原子為F,核外有9個(gè)電子,F的核外電子排布式為1s22s22p5;
(2)同一主族元素,元素的非金屬性越強(qiáng),其氫化物的穩(wěn)定性越強(qiáng)、其最高價(jià)氧化物的水化物酸性越強(qiáng)、其單質(zhì)的氧化性越強(qiáng),與物質(zhì)的沸點(diǎn)、氫化物水溶液的酸性無(wú)關(guān),故選bc;
(3)NaClO3轉(zhuǎn)化為KClO3,說(shuō)明該反應(yīng)中兩種物質(zhì)相互交換離子生成鹽,為復(fù)分解反應(yīng),相同溫度下,溶解度小的物質(zhì)先析出,室溫下KClO3在水中的溶解度明顯小于其它晶體,所以先析出KClO3;
(4)SiCl4為共價(jià)化合物,氯原子和硅原子都達(dá)到8個(gè)電子,SiCl4的電子式為: ;7kg純硅的物質(zhì)的量為:
;7kg純硅的物質(zhì)的量為:![]() =250mol,生成250mol硅吸收akJ熱量,則生成1mol硅吸收的熱量為:
=250mol,生成250mol硅吸收akJ熱量,則生成1mol硅吸收的熱量為:![]() =0.004akJ,所以SiCl4與氫氣反應(yīng)生成單質(zhì)硅和氯化氫的熱化學(xué)方程式為:2H2(g)+SiCl4(g)=Si(s)+4HCl(g) △H=+0.004akJ·mol-1或SiCl4(g)+2H2(g)=Si(s)+4HCl(g)-0.004akJ;
=0.004akJ,所以SiCl4與氫氣反應(yīng)生成單質(zhì)硅和氯化氫的熱化學(xué)方程式為:2H2(g)+SiCl4(g)=Si(s)+4HCl(g) △H=+0.004akJ·mol-1或SiCl4(g)+2H2(g)=Si(s)+4HCl(g)-0.004akJ;
(5)Cl2氧化NaClO2溶液制取ClO2,本身被還原為氯離子,1個(gè)氯氣分子反應(yīng)得到2個(gè)電子,反應(yīng)的離子方程式和電子轉(zhuǎn)移為: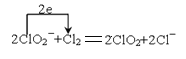 。
。


 閱讀快車系列答案
閱讀快車系列答案
| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:
【題目】明代《天工開(kāi)物》記載了“火法”冶煉鋅的方法:“爐甘石十斤,裝載入一泥罐內(nèi),…然后逐層用煤炭餅墊盛,其底鋪薪,發(fā)火煅紅,…冷淀,毀罐取出,…,即倭鉛也”,現(xiàn)代工業(yè)開(kāi)發(fā)了用NH3—NH4Cl水溶液浸出氧化鋅煙灰(主要成分為ZnO 、少量Pb、CuO和As2O3)制取高純鋅的工藝流程如圖所示。
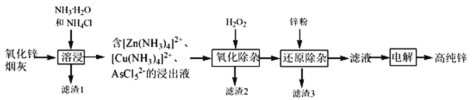
請(qǐng)回答下列問(wèn)題:
(1)《天工開(kāi)物》中煉鋅的方法中“泥封”的目的是____________。
(2)濾渣1的主要成份分別是_______(填化學(xué)式),“過(guò)濾”用到的玻璃儀器是__________。
(3) “溶浸”時(shí),氧化銅參與反應(yīng)的相關(guān)離子方程式是________;“溶浸”時(shí)可以適當(dāng)升高溫度,但不宜過(guò)高,其原因是________________。
(4) “氧化除雜”的目的是將AsCl52-轉(zhuǎn)化為As2O5膠體,再經(jīng)吸附聚沉除去,溶液始終接近中性,該反應(yīng)的離子方程式是_____________________。
(5) “電解”含 [Zn(NH3)4]2+的溶液,陰極放電的電極反應(yīng)式是_________。陽(yáng)極區(qū)產(chǎn)生一種無(wú)色無(wú)味的氣體,將其通入滴有KSCN的FeCl2溶液中,無(wú)明顯現(xiàn)象,該氣體是_______(寫化學(xué)式)。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】含硫化合物在生產(chǎn)、生活中有廣泛應(yīng)用,其吸收和處理也十分重要。回答下列問(wèn)題:
1.SO2具有還原性,寫出將SO2氣體通入 FeCl3溶液中的離子方程式_________,并標(biāo)出電子轉(zhuǎn)移的數(shù)目及方向。_____________________________________________________________
2.在Na2SO3溶液中滴加酚酞,溶液變紅色,若在該溶液中滴入過(guò)量的BaCl2溶液,現(xiàn)象是_________,請(qǐng)結(jié)合離子方程式,運(yùn)用平衡原理進(jìn)行解釋_____________________。
3.等體積等物質(zhì)的量濃度的 NaClO溶液與Na2SO3溶液混合后,溶液顯______性。此時(shí)溶液中濃度相等的微粒是___________________________________________。
4.已知:H2S:Ki1=1.3×10-7Ki2=7.1×10-15 H2CO3:Ki1=4.3×10-7Ki2=5.6×10-11
含H2S尾氣用足量的Na2CO3溶液來(lái)吸收。寫出離子反應(yīng)方程式。____________
常溫時(shí),等體積等濃度的Na2S和Na2CO3溶液的離子總數(shù):N前___N后(填“>”或“<”)。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】能源問(wèn)題是現(xiàn)代社會(huì)發(fā)展的三大基本問(wèn)題之一。
(1)焦炭可用于制取水煤氣。實(shí)驗(yàn)測(cè)得1.2 g 碳與水蒸氣完全反應(yīng)生成水煤氣時(shí),吸收了13.16 kJ熱量。該反應(yīng)的熱化學(xué)方程式為_________________________;該反應(yīng)在________條件下能自發(fā)進(jìn)行(選“高溫”、“低溫”或“任意溫度”)。
(2)甲醇(CH3OH)廣泛用作燃料電池的燃料,工業(yè)上可由CO和H2來(lái)合成,化學(xué)方程式為CO(g)+2H2(g)![]() CH3OH(g)。如圖是在不同溫度下CO的轉(zhuǎn)化率隨時(shí)間變化的曲線。
CH3OH(g)。如圖是在不同溫度下CO的轉(zhuǎn)化率隨時(shí)間變化的曲線。
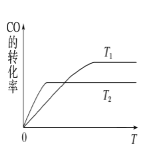
①T1________T2(填“>”、“<”或“=”)。T1和T2溫度下的平衡常數(shù)大小關(guān)系是K1________(填“>”、“<”或“=”)K2。
②若容器容積不變,下列措施不能增加CO轉(zhuǎn)化率的是________(填字母)。
a.降低溫度 b.將CH3OH(g)從體系中分離
c.使用合適的催化劑 d.充入He,使體系總壓強(qiáng)增大
③生成甲醇的化學(xué)反應(yīng)速率(v)與時(shí)間(t)的關(guān)系如圖所示。則圖中t2時(shí)采取的措施可能是___________________;
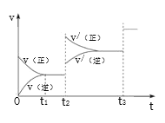
t3時(shí)采取的措施可能是 _________________。
④若在T1℃時(shí),往一密閉容器通入等物質(zhì)的量CO和H2測(cè)得容器內(nèi)總壓強(qiáng)1MPa,40min達(dá)平衡時(shí)測(cè)得容器內(nèi)總壓強(qiáng)為0.6MPa,計(jì)算生成甲醇的壓強(qiáng)平衡常數(shù)KP=________(MPa)-2(用平衡分壓代替平衡濃度計(jì)算,分壓=總壓×物質(zhì)的量分?jǐn)?shù))。
(3)甲醇(CH3OH)燃料電池是以鉑為電極,以KOH溶液為電解質(zhì)溶液,在兩極區(qū)分別加入CH3OH和O2即可產(chǎn)生電流。負(fù)極加入的物質(zhì)是________;正極的電極反應(yīng)為_______________________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】通過(guò)學(xué)習(xí),同學(xué)們對(duì)宏觀辨識(shí)與微觀探析,變化觀念與平衡思想等學(xué)科素養(yǎng)有了進(jìn)一步的認(rèn)識(shí)和理解。請(qǐng)根據(jù)所學(xué)知識(shí)回答下列問(wèn)題:
(1)FeCl3溶液呈________性(填“酸”、“中”或“堿”),原因是__________________(用離子方程式表示);若把FeCl3溶液蒸干,灼燒,最后得到固體產(chǎn)物是 ____________,原因是________________________________________________。
(2)將1L 0.2 mol·L-1HA溶液與1L 0.1 mol·L-1NaOH溶液等體積混合(混合后溶液體積變化忽略不計(jì)),測(cè)得混合溶液中c(Na+)>c(A-),則混合溶液中c(HA)+c(A-)_____0.1 mol·L-1(填“>”、“<”或“=”)。
(3)濃度均為0.1 mol/L的四種溶液①氯化銨溶液、②碳酸氫銨溶液、③氨水、④硫酸氫銨中,NH4+濃度由大到小的順序?yàn)?/span>_______________________________。
(4)鉛蓄電池是典型的可充電型電池,電池總反應(yīng)式為:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。放電時(shí),負(fù)極的電極反應(yīng)式是__________________________;充電時(shí),當(dāng)外電路通過(guò)1 mol電子時(shí),理論上正極板的質(zhì)量減少________________g。
2PbSO4+2H2O。放電時(shí),負(fù)極的電極反應(yīng)式是__________________________;充電時(shí),當(dāng)外電路通過(guò)1 mol電子時(shí),理論上正極板的質(zhì)量減少________________g。
(5)已知:常溫下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常溫下,某酸性MgCl2溶液中含有少量的FeCl3 ,為了得到純凈的MgCl2·2H2O晶體,應(yīng)加入________(填化學(xué)式),調(diào)節(jié)溶液的pH=4,使溶液中的Fe3+轉(zhuǎn)化為Fe(OH)3沉淀,此時(shí)溶液中的c(Fe3+)=________mol·L-1。
②常溫下,若將0.01 mol·L-1 MgCl2溶液與________ mol·L-1 NaOH溶液等體積混合時(shí)有沉淀生成。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】硫酸是一種重要的工業(yè)原料,廣泛應(yīng)用于煉油、冶金、染料等工業(yè)中。硫酸性質(zhì)是中學(xué)化學(xué)學(xué)習(xí)的重點(diǎn)。
請(qǐng)回答下列問(wèn)題:
(1)寫出中學(xué)化學(xué)中利用物質(zhì)與濃硫酸共熱產(chǎn)生不同類別的兩種氣體的名稱:___、___。
(2)濃硫酸脫水性實(shí)驗(yàn)教材中如下操作:取20g蔗糖置200mL燒杯中,加2mL水,攪拌均勻。再加入20mL98%的濃硫酸,迅速攪拌,靜置。實(shí)驗(yàn)中,生產(chǎn)大量含SO2、CO2等混合氣體。寫出產(chǎn)生該混合氣體的化學(xué)方程式:___。
(3)有學(xué)生改進(jìn)了濃硫酸的脫水性實(shí)驗(yàn)(裝置如圖):
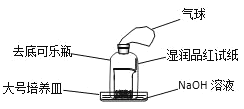
實(shí)驗(yàn)準(zhǔn)備就緒后,加入濃硫酸,迅速攪拌后用去底可樂(lè)瓶罩上,觀察現(xiàn)象。除看到燒杯中白色蔗糖顏色變深,體積膨脹,有氣體產(chǎn)生外,還可看到哪些現(xiàn)象?___。
(4)圖中,儀器a、b的名稱分別是___、___;其中,儀器b常用于操作___(填一種物質(zhì)提純操作)。

(5)有學(xué)生為了確定濃硫酸使蔗糖脫水過(guò)程中產(chǎn)生SO2、CO2氣體,請(qǐng)選用上述裝置(可重復(fù)使用)設(shè)計(jì)實(shí)驗(yàn),將它們的編號(hào)填入方框,并將裝置內(nèi)所放的化學(xué)藥品填入括號(hào)內(nèi)___。
![]()
(濃硫酸,蔗糖)________________________。
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】設(shè)NA為阿伏加德羅常數(shù)值。下列有關(guān)敘述正確的是
A. 標(biāo)準(zhǔn)狀況下,11.2L14CO2含有的中子數(shù)為11NA
B. 5.6gFe粉與足量S粉加熱充分反應(yīng)轉(zhuǎn)移的電子數(shù)為0.2NA,
C. 1molNa2O2固體中所含離子數(shù)目為4NA
D. 1LpH=6的純水中含有OHˉ的數(shù)目為10-8NA
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】N2O5是一種新型硝化劑,在一定溫度下可發(fā)生以下反應(yīng):2N2O5(g)=4NO2(g)+O2(g),△ H>0, T1溫度時(shí),向密閉容器中通入N2O5,部分實(shí)驗(yàn)數(shù)據(jù)見(jiàn)表下列說(shuō)法中不正確的是
時(shí)間/s | 0 | 500 | 1000 | 1500 |
c (N2O5) /rnol/L | 5.00 | 3.52 | 2.50 | 2.50 |
A. 500s內(nèi)用O2表示的平均速率為1.48×10-3mol/(L-s)
B. T1溫度下的平衡常數(shù)為K1,T2溫度下的平衡常數(shù)為K2,若T1>T2,則K1<K2
C. T1溫度下N2O5的平衡轉(zhuǎn)化率為50%
D. 平衡后其它條件不變,將容器的體積壓縮到原來(lái)的一半,則再平衡時(shí) c(N2O5)>5.00mol/L
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:
【題目】研究發(fā)現(xiàn),有機(jī)物G具有很好的抗病毒作用。合成路線如圖:
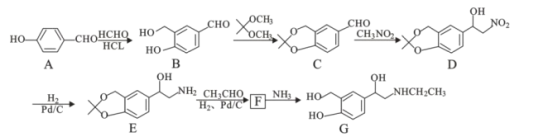
(1)物質(zhì)C中官能團(tuán)有__(寫名稱)
(2)A→B發(fā)生反應(yīng)的類型是__。
(3)結(jié)合整個(gè)合成路線,反應(yīng)B→C的目的是___。
(4)化合物F的分子式為C14H21NO3,則其結(jié)構(gòu)簡(jiǎn)式為___。
(5)同時(shí)滿足下列條件的B的同分異構(gòu)體有___種
①分子中含苯環(huán),能與NaHCO3反應(yīng)放出氣體;②能使FeCl3溶液顯紫色
(6)某同學(xué)設(shè)計(jì)以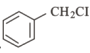 、CH3NO2為原料制備
、CH3NO2為原料制備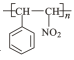 的合成路線如圖,根據(jù)所學(xué)知識(shí)及題中信息,請(qǐng)將流程補(bǔ)充完成(無(wú)機(jī)試劑任選,格式按流程圖)___。
的合成路線如圖,根據(jù)所學(xué)知識(shí)及題中信息,請(qǐng)將流程補(bǔ)充完成(無(wú)機(jī)試劑任選,格式按流程圖)___。

其中第二步反應(yīng)的化學(xué)方程式為___。
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專區(qū) | 電信詐騙舉報(bào)專區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專區(qū) | 涉企侵權(quán)舉報(bào)專區(qū)
違法和不良信息舉報(bào)電話:027-86699610 舉報(bào)郵箱:58377363@163.com