
【題目】研究金屬橋墩的腐蝕及防護是橋梁建設的重要課題。下列有關說法正確的是( )
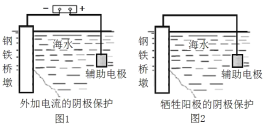
A.圖1輔助電極的材料應為銅
B.圖1通入的保護電流只與鋼鐵橋墩和輔助陽極的材料有關
C.圖2鋼鐵橋墩上發生的反應是O2+2H2O+4e-=4OH-
D.鋼鐵橋墩在河水的腐蝕比海水中更快
科目:高中化學 來源: 題型:
【題目】錳及其化合物在現代工業、農業生產中有著廣泛的應用,同時也是實驗室中常用的重要試劑。
(1)KMnO4是強氧化劑,其溶液中c(H+)=c(OH-),則常溫下0.01molL-1的HMnO4溶液的pH=_____________。
(2)MnS常用于除去污水中的Pb2+等重金屬離子:Pb2+(aq)+ MnS(s)PbS(s)+Mn2+(aq),若經過處理后的水中c(Mn2+)=1 ×10-6 molL-1,則c(Pb2+)=______________[已知Ksp(PbS)=8×10-28、Ksp(MnS)=2×10-13]。
(3)錳是農作物生長的重要微量元素,用硫酸錳溶液拌種可使農作物產量提高10%~15%。某工廠利用回收的廢舊鋅錳干電池生成硫酸錳晶體(MnSO4H2O)的流程如圖所示:
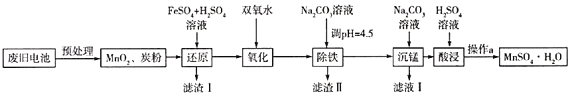
①MnSO4中含有的化學鍵類型有_______________。
②濾渣Ⅱ的主要成分是____________,濾渣Ⅰ是一種黑色單質,“還原”過程中氧化產物是Fe3+,寫出相應反應的離子方程式_________,此反應中MnO2的轉化率與溫度之間的關系如圖所示,則適宜的溫度是______________(填字母)。
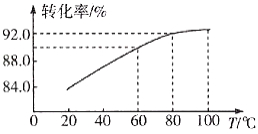
a.40 ℃ b.60 ℃ c.80 ℃ d.100 ℃
③“沉錳”中有無色無味的氣體生成,還有MnCO36Mn(OH)25H2O生成,寫出相應反應的化學方程式_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“中和滴定”原理在實際生產生活中應用廣泛。用I2O5可定量測定CO的含量,該反應原理為5CO+I2O5![]() 5CO2+I2。其實驗步驟如下:
5CO2+I2。其實驗步驟如下:
①取250 mL(標準狀況)含有CO的某氣體樣品,通過盛有足量I2O5的干燥管,在170 ℃下充分反應;
②用水-乙醇混合溶液充分溶解產物I2,配制100 mL溶液;
③量取步驟②中溶液25.00 mL于錐形瓶中,然后用0.01 mol·L-1的Na2S2O3標準溶液滴定。
(1)步驟②中配制100 mL待測溶液需要用到的玻璃儀器的名稱是燒杯、量筒、玻璃棒、膠頭滴管和____________________。
(2)Na2S2O3標準液應裝在__________(填字母)中。

(3)指示劑應選用__________,判斷達到滴定終點的現象是____________。(已知:氣體樣品中其他成分不與I2O5反應:2Na2S2O3+I2=2NaI+Na2S4O6)。
(4)下列操作會造成所測CO的體積分數偏大的是________(填字母)。
a.滴定終點俯視讀數
b.錐形瓶用待測溶液潤洗
c.滴定前有氣泡,滴定后沒有氣泡
d.配制100 mL待測溶液時,有少量濺出
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗裝置能達到實驗目的的是( )
|
|
|
|
A.測定一定時間內生成 H2的反應速率 | B.可以進行中和熱的測定實驗 | C.比較溫度對化學反應速率的影響 | D.比較Cu2+、Fe3+對 H2O2分解速率的影響 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,向盛有 20 mL0.1mol·L-1 的 NaOH 溶液的絕熱容器中加入 pH=2 的 HA 溶液,加入 HA 溶液的體積 V與所得混合溶液溫度 T的關系如圖所示。 下列說法錯誤的是

A.25℃時 pH=2 的 HA 溶液中 HA 的電離度約為 10%
B.M 點溶液中存在:c(Na+ ) > c(A-)> c(OH-)> c(H+)
C.P 點溶液中存在:3 c(Na+ )=2 c(HA)+ 2c(A-)
D.M→N→P 的過程中水的電離程度先增大后減小,M 點水電離程度小于 P 點
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硒(Se)是第四周期第ⅥA族元素,是人體內不可或缺的微量元素,H2Se是制備新型光伏太陽能電池、半導體材料和金屬硒化物的重要原料。
(1)已知:①2H2Se(g)+O2(g)![]() 2Se(s)+2H2O(l) ΔH1=akJ·mol-1
2Se(s)+2H2O(l) ΔH1=akJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=bkJ·mol-1
2H2O(l) ΔH2=bkJ·mol-1
反應H2(g)+Se(s)![]() H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代數式表示)。
H2Se(g)的ΔH3=__kJ·mol-1(用含a、b的代數式表示)。
(2)T℃時,向一恒容密閉容器中加入3molH2和1molSe,發生反應H2(g)+Se(s)![]() H2Se(g)。
H2Se(g)。
①下列情況可判斷反應達到平衡狀態的是__(填字母代號)。
a.氣體的密度不變 b.v(H2)=v(H2Se)
c.氣體的壓強不變 d.氣體的平均摩爾質量不變
②當反應達到平衡后,將平衡混合氣體通入氣體液化分離器使H2Se氣體轉化為H2Se液體,并將分離出的H2再次通入發生反應的密閉容器中繼續與Se反應時,Se的轉化率會提高。請用化學平衡理論解釋:_。
③以5小時內得到的H2Se為產量指標,且溫度、壓強對H2Se產率的影響如圖1、圖2所示:
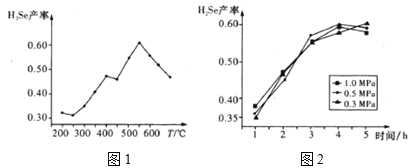
則制備H2Se的最佳溫度和壓強為__。
(3)已知常溫下H2Se的電離平衡常數K1=1.3×10-4、K2=5.0×10-11,則NaHSe溶液呈__(填“酸性”或“堿性”),請通過計算數據說明__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將0.10mol·L-1的NaOH溶液滴加到10.00mL0.10mol·L-1HX溶液中,所得滴定曲線如圖,已知HX的電離平衡常數為1.0×10-9,下列說法錯誤的是( )

A.①處pH約為5
B.②處pH一定大于7
C.水的電離程度:③>純水>②
D.②中離子濃度大小關系:c(Na+)>c(X-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氧化硅晶體是立體的網狀結構,其結構如圖所示.關于二氧化硅晶體的下列說法不正確的是( )
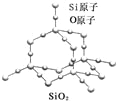
A. 晶體中Si、O原子個數比為1:2
B. 晶體中Si、O原子最外層都滿足8電子結構
C. 晶體中一個硅原子含有Si﹣O鍵數目為4
D. 晶體中最小環上的原子數為6
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醛分子的結構式如圖所示,下列描述正確的是( )
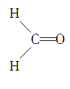
A. 甲醛分子中有4個σ鍵
B. 甲醛分子中的C原子為sp3雜化
C. 甲醛分子中的O原子為sp雜化
D. 甲醛分子為平面三角形,有一個π鍵垂直于三角形平面
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com