
| 物質 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 開始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
| 難溶電解質 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
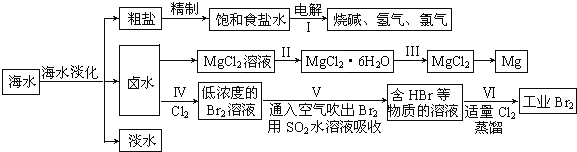
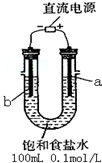
分析 (一)(1)裝置圖中與直流電源正極連接的電極a為陽極,溶液中氯離子失電子發生氧化反應生成氯氣,電極反應為:2Cl--2e-=Cl2↑;
(2)陰極發生2H++2e-=H2↑,22.4mL為0.5×10-3mol氫氣,
(二)(3)把MgCl2粗產品的溶液中的Fe2+轉化為Fe3+,可選用的物質是過氧化氫或氯氣,氧化亞鐵離子為鐵離子,調節溶液PH除去,加入的試劑不引入新的雜質;
(4)氯化鎂易水解,應在氯化氫氣流中獲得其晶體;
(5)由無水氯化鎂制取金屬鎂的化學反應方程式 MgCl2 $\frac{\underline{\;通電\;}}{\;}$Mg+Cl2↑;
(6)根據題目中所給難溶電解質的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更難溶;
(三)海水淡化后得到NaCl、母液、淡水,電解氯化鈉溶液得到氯氣,2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+Cl2↑+H2↑,將氯氣通入母液中發生反應2Br-+Cl2=2Cl-+Br2,溴和二氧化硫發生反應Br2+SO2+2H2O=2HBr+H2SO4,再向含有HBr的溶液中通入適量氯氣蒸餾得到溴單質,再結合物質的性質解答;
(7)富集溴元素;
(8)用SO2水溶液吸收Br2的反應發生氧化還原反應生成氫溴酸和硫酸.
解答 解:(一)(1)裝置圖中與直流電源正極連接的電極a為陽極,溶液中氯離子失電子發生氧化反應生成氯氣,電極反應為:2Cl--2e-=Cl2↑;
故答案為:石墨;2Cl--2e-=Cl2↑;
(2)陰極發生2H++2e-=H2↑,11,2mL為0.5×10-3mol氫氣,則生成0.001molOH-,則c(OH-)=$\frac{0.001mol}{0.1L}$=0.01mol/L,溶液pH=12,故答案為:12;
(二)(3)把MgCl2粗產品的溶液中的Fe2+轉化為Fe3+,可選用的物質是過氧化氫、氯氣,氧化亞鐵離子為鐵離子,調節溶液PH除去,加入的試劑不引入新的雜質應選擇氧化鎂,可用碳酸鎂;
故答案為:ad;e;
(4)如果直接在空氣中加熱MgCl2•6H2O則Mg2+會水解的生成Mg(OH)Cl和HCl,通入HCl可以抑制其水解,應在氯化氫氣流中失水獲得氯化鎂晶體;
故答案為:應在氯化氫氣流中失水獲得氯化鎂晶體;
(5)由無水氯化鎂制取金屬鎂的化學反應方程式 MgCl2 $\frac{\underline{\;通電\;}}{\;}$Mg+Cl2↑,故答案為:MgCl2 $\frac{\underline{\;通電\;}}{\;}$Mg+Cl2↑;
(6)根據題目中所給難溶電解質的Ksp,可知Cu2+和Pb2+的硫化物Ksp更小,更難溶;所以用Na2S除去污水中的Cu2+和Pb2+效果更好,故答案為:Na2S;
(三)海水淡化后得到NaCl、母液、淡水,電解氯化鈉溶液得到氯氣,2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$2NaOH+Cl2↑+H2↑,將氯氣通入母液中發生反應2Br-+Cl2=2Cl-+Br2,溴和二氧化硫發生反應Br2+SO2+2H2O=2HBr+H2SO4,再向含有HBr的溶液中通入適量氯氣蒸餾得到溴單質,
(7)步驟I中已獲得Br2,步驟II中又將Br2還原為Br-,步驟I中獲取的溴濃度較小,所以其目的是富集溴元素;
故答案為:富集溴元素;
(8)溴具有強氧化性,二氧化硫具有還原性,二者能發生氧化還原生成硫酸和氫溴酸,離子反應方程式為:Br2+SO2+2H2O=4H++SO42-+2Br-;
故答案為:Br2+SO2+2H2O=4H++SO42-+2Br-.
點評 本題考查物質的分離、提純,涉及海水資源的開發和利用,涉及電解原理、氧化還原反應等知識點,側重于學生的分析能力和實驗能力的考查,根據金屬的活動性強弱與冶煉方法的選取、電解原理、物質的性質等知識點來分析解答,注意由帶結晶水的氯化鎂制取氯化鎂的條件,為易錯點,題目難度中等.


 名校聯盟快樂課堂系列答案
名校聯盟快樂課堂系列答案 黃岡創優卷系列答案
黃岡創優卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | c(CO32-)的大小關系為:②>⑤>③>④>① | |
| B. | 將溶液蒸干灼燒只有②能得到對應的固體物質 | |
| C. | ③④⑤既能與鹽酸反應,又能與NaOH溶液反應 | |
| D. | c(HCO3-)的大小關系為:④>③>⑤>②>① |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用敞開放置久了的濃硫酸進行配制 | B. | 量取濃硫酸仰視刻度線 | ||
| C. | 配制過程中未洗滌燒杯和玻璃棒 | D. | 配制前,容量瓶有少許蒸餾水 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
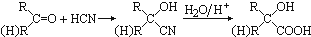 ,CO和H2按物質的量之比1:2可以制得G,有機玻璃可按下列路線合成:
,CO和H2按物質的量之比1:2可以制得G,有機玻璃可按下列路線合成: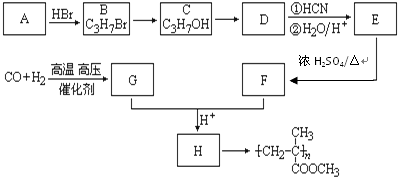
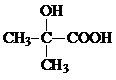 ;
; ;
;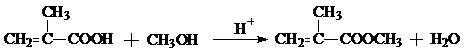 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 應選用100mL容量瓶 | |
| B. | 配置之前容量瓶中殘留的蒸餾水會導致濃度偏高 | |
| C. | 定容時腐蝕刻度會導致濃度偏低 | |
| D. | 搖勻、靜置后發現凹液面低于刻度線,再加水至刻度線即可 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵與稀硫酸反應 2Fe+6H+═2Fe3++3H2↑ | |
| B. | 氫氧化鋁與足量鹽酸反應 Al(OH)3+3H+═Al3++3H2O | |
| C. | 鈉和冷水反應 Na+2H2O═Na++H2↑+OH- | |
| D. | 銅片與稀硝酸反應 Cu+NO3-+4H+═Cu2++NO↑+2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com