
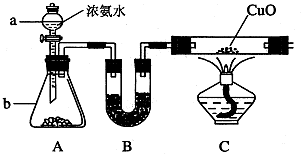
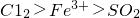 的氧化性順序,某小組用下圖所示裝置進行實驗(夾持儀器和A中的加熱裝置已省略,氣密性已經檢驗).
的氧化性順序,某小組用下圖所示裝置進行實驗(夾持儀器和A中的加熱裝置已省略,氣密性已經檢驗).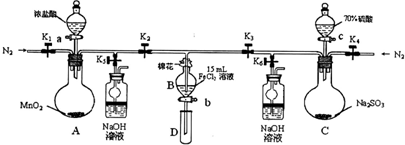
 所需的試劑是______.
所需的試劑是______.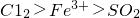 的是______.
的是______.| 第一次B中溶液含有離子 | 第二次B中溶液含有離子 | |
| 甲 | 有Fe2+,無Fe3+ | 有SO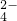 |
| 乙 | 既有Fe3+,又有Fe2+ | 有SO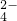 |
| 丙 | 有Fe3+,無Fe2+ | 有Fe2+ |
 Mn2++Cl2↑+H2O,故答案為:MnO2+4H++2Cl-
Mn2++Cl2↑+H2O,故答案為:MnO2+4H++2Cl- Mn2++Cl2↑+H2O;
Mn2++Cl2↑+H2O;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:閱讀理解

| ||
| ||
| 第一次B中溶液含有離子 | 第二次B中溶液含有離子 | |
| 甲 | 有Fe2+,無Fe3+ | 有SO 42- |
| 乙 | 既有Fe3+,又有Fe2+ | 有SO 42- |
| 丙 | 有Fe3+,無Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:同步題 題型:實驗題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com