
【題目】設NA表示阿伏加德羅常數的數值,下列敘述正確的是
①標況下2.24L己烷中,含1.4NA個C-H鍵
②常溫常壓下,16gO2和O3混合氣體中,電子數為8NA
③過氧化鈉與水反應,產生3.2g氧氣,則電子轉移數目為0.2NA
④0.1mol/LKAl(SO4)2溶液中含Al3+數目小于0.1NA
⑤將0.1molFeCl3配成氫氧化鐵膠體,膠體粒子數目最多可達到0.1NA
⑥將2.8gN2與足量氫氣充分反應,得到氨氣分子數目少于0.2NA
A. ①②④⑥ B. ③④⑤⑥
C. ②③⑥ D. ②③④
【答案】C
【解析】①標準狀況下,己烷不是氣體,2.24L己烷物質的量不是0.1mol,故①錯誤;②16gO2和O3混合氣體含O物質的量為1mol,故電子數為8NA,②正確;③過氧化鈉與水反應為Na2O2中氧元素的歧化反應, ,生成1molO2轉移2mol電子,所以生成3.2g氧氣(0.1mol),則電子轉移數目為0.2NA,故③正確;④溶液體積未知,無法計算Al3+數目,故④錯誤;⑤膠體粒子是Fe(OH)3微粒的集合體,故0.1molFeCl3最多生成0.1NA個Fe(OH)3微粒,膠體粒子數目小于0.1NA,⑤錯誤;⑥若2.8gN2(0.1mol)完全反應,則得到氨氣分子數目等于0.2NA,因為該反應為可逆反應,故得到氨氣分子數目少于0.2NA,⑥正確。綜上,②③⑥正確,選C。
,生成1molO2轉移2mol電子,所以生成3.2g氧氣(0.1mol),則電子轉移數目為0.2NA,故③正確;④溶液體積未知,無法計算Al3+數目,故④錯誤;⑤膠體粒子是Fe(OH)3微粒的集合體,故0.1molFeCl3最多生成0.1NA個Fe(OH)3微粒,膠體粒子數目小于0.1NA,⑤錯誤;⑥若2.8gN2(0.1mol)完全反應,則得到氨氣分子數目等于0.2NA,因為該反應為可逆反應,故得到氨氣分子數目少于0.2NA,⑥正確。綜上,②③⑥正確,選C。


科目:高中化學 來源: 題型:
【題目】如圖,甲、乙、丙分別表示在不同條件下可逆反應:A(g)+B(g)![]() xC(g)的生成物 C在反應混合物中的體積分數和反應時間的關系。
xC(g)的生成物 C在反應混合物中的體積分數和反應時間的關系。

(1)若甲圖中兩條曲線分別代表有催化劑和無催化劑的情況,則 曲線表示無催化劑時的情況,反應速率:a b(填“大于”“小于”或“等于”)。
(2)若乙圖表示反應達到平衡后,分別在恒溫恒壓條件下和恒溫恒容條件下向平衡混合氣體中充入氦氣后的情況,則 曲線表示恒溫恒容的情況,在恒溫恒容條件下,C的體積分數 (填“變大”“變小”或“不變”)。
(3)根據丙圖可以判斷該可逆反應的正反應是 (填“放熱”或“吸熱”)反應,化學計量數x的值(或取值范圍)是 。
(4)丁圖表示在某固定容積的密閉容器中,上述可逆反應達到平衡后,某物理量隨著溫度(T)的變化情況,根據你的理解,丁圖的縱軸可以是 [填:①φ(C)/% ②A的轉化率 ③B的轉化率 ④壓強 ⑤c(A) ⑥c(B)];升溫平衡移動的方向為 (填“左移”或“右移”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】立足教材實驗是掌握高中化學實驗的基礎,是理解化學科學的實驗原理、實驗方法和實驗思路,提高學生實驗能力的基本途徑:
(1)實驗1:取一塊金屬鈉,在玻璃片上用濾紙吸干表面的煤油后,用小刀切去一端的外皮,觀察鈉的顏色,這個實驗中還需用到的一種儀器是_________;
(2)實驗2:向一個盛有水的小燒杯里滴入幾滴酚酞試液,然后把一小塊鈉投入小燒杯,把反應的現象和相應結論填入空格,“浮”--鈉的密度比水小;“紅”--反應生成了氫氧化鈉;“熔”——______________;
(3)實驗3:用坩堝鉗夾住一小塊用砂紙仔細打磨過的鋁,在酒精燈上加熱至熔化,發現熔化的鋁并不滴落。下列關于上述實驗現象的解釋正確的是_________
A.火焰溫度太低不能使鋁燃燒 B.鋁在空氣中能很快形成氧化膜
C.氧化鋁的熔點比倡的熔點高 D.打磨砂紙不能除去表面的氧化膜
(4)實驗4:把少量水滴入盛有Na2O2固體的試管中,立即用帶火星的木條放在試管口,檢驗
生成的氣體體,向反應后的溶液中加入酚酞試液,可以看到__________;
(5)實驗5:在玻璃管中放入還原鐵粉和石棉絨的混合物,加熱,并通入水蒸氣,該氧化還原反應的氧化劑是__________,該反應每消耗1mol鐵,轉移電子的物質的量為_________。
(6)實驗6:在試管中注入少量新制備的FeSO4溶液,用膠頭滴管吸取NaOH溶液,將滴管尖端插入試管里溶液底部,慢慢擠出NaOH溶液,可以看到開始時析出一種白色的絮狀沉淀,并迅速變成灰綠色,最后變成紅褐色,發生這種顏也變化的原因是(用化學方程式表示):______。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為1.00 L的容器中,通入一定量的N2O4,發生反應N2O4(g) ![]() 2NO2(g) ΔH,隨溫度升高,混合氣體的顏色變深。
2NO2(g) ΔH,隨溫度升高,混合氣體的顏色變深。

回答下列問題:
(1)反應的ΔH__________0(填“>”或“<”);100℃時,體系中各物質濃度隨時間變化如圖所示。在0~60 s時段,平均反應速率v(NO2)為__________molL-1s-1,反應的平衡常數K為____________________________。
(2)100℃時達到平衡后,改變反應溫度為T,c(N2O4) 以0.0020 molL-1s-1的平均速率降低,經10 s又達到平衡。則T__________100℃(填“大于”或“小于”)。
(3)利用圖(a)和(b)中的信息,按圖(b)裝置(連通的A、B瓶中已充有NO2氣體)進行實驗。可觀察到B瓶中氣體顏色比A瓶中的_________(填“深”或“淺”),其原因是_____________________________。


查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅粉放入稀硫酸溶液中,加熱后無明顯變化,但加入某鹽一段時間后,發現銅粉溶解,溶液呈藍色,且無氣體逸出,該鹽可能是
A. FeC13 B. Na2CO3 C. KNO3 D. FeSO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用酸性KMnO4和H2C2O4(草酸)反應研究影響反應速率的因素。一實驗小組欲通過測定單位時間內生成CO2的速率,探究某種影響化學反應速率的因素,設計實驗方案如下(KMnO4溶液已酸化):
實驗序號 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |

(1)該反應的離子方程式 。(已知H2C2O4是二元弱酸)
(2)該實驗探究的是 因素對化學反應速率的影響。相同時間內針筒中所得CO2的體積大小關系是 < (填實驗序號)。
(3)若實驗①在2 min末收集了2.24 mL CO2(標準狀況下),則在2 min末, c(MnO4-)=__________mol/L(假設混合液體積為50 mL)
(4)除通過測定一定時間內CO2的體積來比較反應速率,本實驗還可通過測定 來比較化學反應速率。(一條即可)
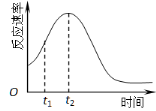 (5)小組同學發現反應速率總是如圖,其中t1~t2時間內速率變快的主要原因可能是:
(5)小組同學發現反應速率總是如圖,其中t1~t2時間內速率變快的主要原因可能是:

① ;② 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根據這兩種溶液的配制情況回答下列問題:

(1)如圖所示的儀器中配制溶液肯定不需要的是___(填序號),配制上述溶液還需用到的玻璃儀器是____________(填儀器名稱)。
(2)下列操作中,容量瓶所不具備的功能有______(填序號)。
A.配制一定體積準確濃度的標準溶液 B.貯存溶液
C.測量容量瓶規格以下的任意體積的液體 D.準確稀釋某一濃度的溶液
E.量取一定體積的液體 F.用來加熱溶解固體溶質
(3)根據計算用托盤天平稱取NaOH的質量為________g。在實驗中其他操作均正確,若定容時俯視刻度線,則所得溶液濃度______0.1 mol·L-1(填“大于”“等于”或“小于”,下同)。
(4)根據計算可知,所需質量分數為98%、密度為1.84 g·cm-3的濃硫酸的體積為________mL(計算結果保留一位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氯酸鉀和濃鹽酸之間有下列反應:2KClO3 + 4HCl(濃)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O。
(1)該反應中發生還原反應的物質是__________。氧化產物是___________。
(2)用雙線橋標出方程式中的電子得失___________。
2KClO3 + 4HCl(濃)== 2 KCl + Cl2↑+ 2ClO2 + 2H2O
(3)當有0.2mol電子發生轉移時,生成的氯氣的體積為_____L(標準狀況)。被氧化的HCl的物質的量為____mol。
(4)若分別用①KMnO4(還原產物是Mn2+)②MnO2(還原產物是Mn2+)③Ca(ClO)2(還原產物是Cl2)氧化濃鹽酸制備氯氣,當濃鹽酸足量且這三種氧化劑的物質的量相同時,生成氯氣的物質的量最少的是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是( )
A. 碳酸鈣跟醋酸反應:CaCO3+2H+===Ca2++CO2↑+H2O
B. 金屬鈉加入到CuSO4溶液中:2Na+Cu2+===Cu+2Na+
C. 鐵跟稀鹽酸反應:Fe+2H+===Fe2++H2↑
D. 碳酸氫鈣溶液跟足量燒堿溶液反應:Ca2++HCO![]() +OH-===CaCO3↓+H2O
+OH-===CaCO3↓+H2O
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com