
| A. | c(CH3COOH)>c(Na+) | B. | c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | c(CH3COOH)>c(CH3COO-) | D. | c(CH3COOH)=c(CH3COO-)+c(H+) |
分析 同濃度、同體積的CH3COOH和CH3COONa溶液,溶液呈酸性說明醋酸電離大于醋酸根離子的水解程度,則:c(CH3COOH)<c(CH3COO-),溶液中存在物料守恒:c(CH2COOH)+c(CH3COO-)=2c(Na+),則c(CH3COOH)<c(Na+)<c(CH3COO-),溶液中還存在電荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),據此對各選項進行判斷.
解答 解:A.等濃度、等體積的醋酸鈉和醋酸的混合液呈酸性,說明醋酸電離大于醋酸根離子的水解程度,則:c(CH2COOH)<c(CH3COO-),溶液中存在物料守恒:c(CH2COOH)+c(CH3COO-)=2c(Na+),則c(CH3COOH)<c(Na+)<c(CH3COO-),故A錯誤;
B.溶液中還存在電荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故B正確;
C.根據A的分析可知,c(CH3COOH)<c(Na+)<c(CH3COO-),故C錯誤;
D.混合液呈酸性,說明醋酸電離大于醋酸根離子的水解程度,則c(CH2COOH)<c(CH3COO-),所以c(CH3COOH)<c(CH3COO-)+c(H+),故D錯誤;
故選B.
點評 本題考查了離子濃度大小比較,題目難度中等,明確電荷守恒、物料守恒及鹽的水解原理為解答關鍵,試題側重考查學生的分析、理解能力及靈活應用基礎知識的能力.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol任何物質都含有約6.02×1023個原子 | |
| B. | 物質的量是度量物質所含微觀粒子多少的物理量 | |
| C. | 利用丁達爾效應可以區別溶液與膠體 | |
| D. | 等質量的O2和O3中所含氧原子個數相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 |  |  |  | |
| 化工 | 氯堿工業 | 高爐煉鐵 | 銅的精煉 | 生產漂白粉 |
| 原理 | 2NaCl+2H2O$\frac{\underline{\;電解\;}}{\;}$ 2NaOH+Cl2↑+ H2↑ | 3CO+Fe2O3 $\frac{\underline{\;高溫\;}}{\;}$2Fe+3CO2 | 陰極: Cu2++2e-═Cu | 2NaOH+Cl2═NaCl+NaClO+H2O |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 實驗 | 1 | 2 | 3 | 4 |
| V(KMnO4)/mL | 19.50 | 21.50 | 19.48 | 19.52 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 元素 | 相關信息 |
| X | X的最高價氧化物對應的水化物化學式為H2XO3 |
| Y | Y是地殼中含量最高的元素 |
| Z | Z的單質能與強酸、強堿溶液反應放出氫氣 |
| W | W的一種核素的質量數為28,中子數為14 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 元素 | 元素性質或結構 |
| A | 最外層電子數是其內層電子數的2倍 |
| B | B元素的單質在空氣中含量最多 |
| C | C元素在地殼中含量最多 |
| D | D元素在同周期中金屬性最強 |
| E | 常溫常壓下,E元素形成的單質是淡黃色固體,常在火山口附近沉積 |
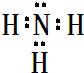 ,屬于共價化合物(填“離子”或“共價”);D的最高價氧化物的水化物電子式
,屬于共價化合物(填“離子”或“共價”);D的最高價氧化物的水化物電子式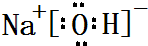 ,所含化學鍵類型:離子鍵、共價鍵.
,所含化學鍵類型:離子鍵、共價鍵.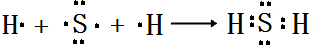 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com