
某化學反應其△H== -122 kJ/mol,∆S== 231 J/(mol·K),則此反應在下列哪種情況下可自發進行
A.在任何溫度下都能自發進行 B.在任何溫度下都不能自發進行
C.僅在高溫下自發進行 D.僅在低溫下自發進行
科目:高中化學 來源:2015-2016學年安徽六安新安中學、南溪中學高一期中聯考化學試卷(解析版) 題型:選擇題
根據圖中包含的信息分析,下列敘述正確的是 ( )
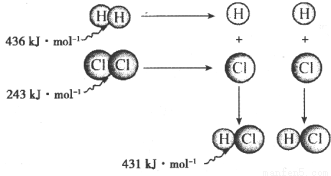
A.氫氣與氯氣反應生成1 mol氯化氫氣體,反應吸收248 kJ的能量
B.436kJ•mol-1是指斷開1 mol H2中的H—H鍵需要放出436 kJ的能量
C.氫氣與氯氣反應生成2 mol氯化氫氣體,反應放出183 kJ的能量
D.431 kJ•mol-1是指生成2mol HCl中的H—Cl鍵需要放出431 kJ的能量
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省邯鄲市高一5月月考化學試卷(解析版) 題型:選擇題
短周期主族元素X、Y、Z、W原子序數依次增大,X原子最外層有7個電子,Y原子最外層電子數是最內層電子數的一半,Z最高正價是最低負價絕對值的3倍。下列敘述正確的是( )
A.Y的離子半徑比X的離子半徑大
B.化合物Y2Z中既有離子鍵、又有共價鍵
C.Y、W最高價氧化物對應水化物的溶液均能溶解氧化鋁
D.簡單氣態氫化物的穩定性由強到弱的順序:Z、W、X
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣西南寧市高二下學期期中化學試卷(解析版) 題型:選擇題
室溫時,CaCO3在水中的溶解平衡曲線如圖所示,已知:25℃其溶度積為2.8×10-9 mol2·L-2,下列說法不正確的是

A.x數值為2×10-5
B.c點時有碳酸鈣沉淀生成
C.加入蒸餾水可使溶液由d點變到a點
D.b點與d點對應的溶度積相等
*
查看答案和解析>>
科目:高中化學 來源:2015-2016學年廣西南寧市高二下學期期中化學試卷(解析版) 題型:選擇題
某溶液中由水電離出來的C(OH—)=10-12mol/L,則該溶液中的溶質不可能是
A.HCl B.NaOH C.NH4Cl D.H2SO4
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(上海卷參考版) 題型:填空題
半水煤氣是工業合成氨的原料氣,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤氣經過下列步驟轉化為合成氨的原料。
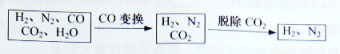
完成下列填空:
(1)半水煤氣含有少量硫化氫。將半水煤氣樣品通入____溶液中(填寫試劑名稱),出現_______,可以證明有硫化氫存在。
(2)半水煤氣在銅催化下實現CO變換:CO+H2O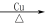 CO2+H2
CO2+H2
若半水煤氣中V(H2):V(CO):V(N2)=38:28:22,經CO變換后的氣體中:V(H2):V(N2)=____________。
(3)堿液吸收法是脫除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃堿液最高濃度(mol/L) | 2.0 | 8.0 |
堿的價格(元/kg) | 1.25 | 9.80 |
若選擇Na2CO3堿液作吸收液,其優點是__________;缺點是____________。如果選擇K2CO3堿液作吸收液,用什么方法可以降低成本?
___________________________________________
寫出這種方法涉及的化學反應方程式。_______________________
(4)以下是測定半水煤氣中H2以及CO的體積分數的實驗方案。
取一定體積(標準狀況)的半水煤氣,經過下列實驗步驟測定其中H2以及CO的體積分數。

①選用合適的無機試劑分別填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②該實驗方案中,步驟________(選填“Ⅳ”或“Ⅴ”)可以確定半水煤氣中H2的體積分數。
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(上海卷參考版) 題型:選擇題
已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32- 、SO42-,且所有離子物質的量濃度相等。向該無色溶液中滴加少量溴水,溶液仍呈無色。下列關于該溶液的判斷正確的是
A.肯定不含I- B.肯定不含SO42-
C.肯定含有SO32- D.肯定含有NH4+
查看答案和解析>>
科目:高中化學 來源:2016年全國普通高等學校招生統一考試化學(上海卷參考版) 題型:選擇題
下列化工生產過程中,未涉及氧化還原反應的是
A.海帶提碘 B.氯堿工業
C.氨堿法制堿 D.海水提溴
查看答案和解析>>
科目:高中化學 來源:2015-2016年浙江寧波效實中學高一下期中化學卷(創)(解析版) 題型:選擇題
在2 L的恒容密閉容器中,發生反應:A(g)+B(g)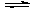 2C(g)+D(s)△H=-a kJ·mol-1,實驗內容和結果分別如下表和下圖所示。下列說法正確的是
2C(g)+D(s)△H=-a kJ·mol-1,實驗內容和結果分別如下表和下圖所示。下列說法正確的是

實驗 序號 | 溫度 | 起始物質的量 | 熱量 變化 | |
A | B | |||
Ⅰ | 600℃ | 1 mol | 3 mol | 96 kJ |
Ⅱ | 800℃ | 0.5 mol | 1.5mol | —— |
A.實驗Ⅰ中,10 min內平均速率v(B)=0.06 mol·L-1·min-1
B.600℃時,上述方程式中a=160
C.600 ℃時,該反應的平衡常數是0.45
D.向實驗Ⅱ的平衡體系中再充入0.5 mol A和1.5 mol B,A的轉化率將改變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com