
【題目】A、B、C、D、E、F六種物質有如下變化關系,E是淡黃色粉末,判斷:
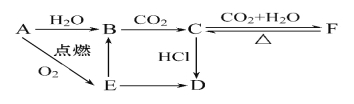
(1)寫出B、C、D、F的化學式:
B. C. D. F. 。
(2)寫出有關反應的離子方程式
B→C: ________________________________,
E→B: _______________________________,
F→C: _______________________________。
【答案】(1)NaOHNa2CO3NaClNaHCO3
(2)2OH-+CO2=CO32-+H2O
2Na2O2+2H2O=4Na++4OH-+O2↑
2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
【解析】
試題分析:E是淡黃色粉末,A燃燒生成E,所以A是Na,E是過氧化鈉,鈉和水反應生成氫氧化鈉,則B是氫氧化鈉,氫氧化鈉吸收CO2生成C是碳酸鈉,碳酸鈉繼續吸收CO2轉化為碳酸氫鈉,即F是碳酸氫鈉,碳酸氫鈉受熱分解生成碳酸鈉。碳酸鈉與鹽酸反應生成D,過氧化鈉和鹽酸反應也生成D,所以D是氯化鈉。
(1)根據以上分析可知B、C、D、F的化學式分別是NaOH、Na2CO3、NaCl、NaHCO3;
(2)根據以上分析可知B→C的方程式為2OH-+CO2=CO32-+H2O;E→B的方程式為2Na2O2+2H2O=4Na++4OH-+O2↑;F→C的方程式為2NaHCO3![]() Na2CO3+H2O+CO2↑。
Na2CO3+H2O+CO2↑。


 同步奧數系列答案
同步奧數系列答案科目:高中化學 來源: 題型:
【題目】關于核酸的敘述中,不正確的是( )
A. DNA和RNA都能攜帶遺傳信息
B. DNA和RNA的基本單位都是核苷酸
C. DNA只分布在細胞核內,RNA只分布在細胞質中
D. 豌豆葉肉細胞內的核酸含有5種堿基
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃、101 kPa下,碳、氫氣、甲烷和葡萄糖的燃燒熱依次是393.5 kJ/mol、285.8 kJ/mol、890.3kJ/mol、2800 kJ/mol。則下列熱化學方程式正確的是
A.C(s)+![]() O2(g)=CO(g);△H= - 393.5 kJ/mol
O2(g)=CO(g);△H= - 393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l);△H=+571.6 kJ/mol
C.CH4(g)+CO2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H=-1400 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在不同條件下分別測得反應2SO2(g)+O2(g) ![]() 2SO3(g)的化學反應速率,其中表示該反應進行的最快的是
2SO3(g)的化學反應速率,其中表示該反應進行的最快的是
A.v(SO2)=4 mol·L-1·min-1 B.v(O2)=3 mol·L-1·min-1
C.v(SO2)=0.1 mol·L-1·s-1 D.v(O2)=0.1 mol·L-1·s-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】ClO2氣體是一種常用的消毒劑,我國從2 000年起逐步用ClO2代替氯氣對飲用水進行消毒。
(1)消毒水時,ClO2還可將水中的Fe2+、Mn2+等轉化成Fe(OH)3和MnO2等難溶物除去,在這個過程中,Fe2+、Mn2+的化合價升高,說明ClO2具有__________性。
(2)工業上可以通過下列方法制取ClO2,請完成該化學反應方程式:
2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通過灼熱的炭層,生成HCl和CO2,是放熱反應,當1 mol Cl2參與反應時 釋放145 kJ的熱量,寫出這個反應的熱化學方程式:________________。
(4)自來水廠用ClO2處理后的水中,要求ClO2的濃度在0.1~0.8 mg·L-1之間。碘量法可以檢 測水中ClO2的濃度,步驟如下:
Ⅰ.取一定體積的水樣,加入一定量的碘化鉀,再用氫氧化鈉溶液調至中性,并加入淀粉溶液,溶液變藍。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
Ⅲ.加硫酸調節水樣pH至1~3。
操作時,不同pH環境中粒子種類如下圖所示:

請回答:
①操作Ⅰ中反應的離子方程式是___________________。
②確定操作Ⅱ完全反應的現象是___________________。
③在操作Ⅲ過程中,溶液又呈藍色,反應的離子方程式是___________________。
④若水樣的體積為1.0L,在操作Ⅱ時消耗了1.0×10-3mol·L-1的Na2S2O3溶液10mL,則水樣中ClO2的濃度是________mg·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應FeO(s)+CO(g) ![]() Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始濃度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,請回答:
Fe(s)+CO2(g) 的Kc=0.5(1273K)。若起始濃度c(CO)=0.05 mol·L-1,c(CO2)=0.01 mol·L-1,請回答:
(1)判斷化學反應進行的方向并計算反應物、生成物的平衡濃度。
(2)CO的轉化率是多少?
(3)增加FeO的量,對平衡有無影響?
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】 螞蟻分泌的蟻酸主要成分是甲酸(結構式為![]() ,Ka=1.8×10-4),通常情況下是一種無色易揮發的液體。甲酸在濃硫酸作用下容易分解產生CO。某化學興趣小組的同學對HCOOH的性質進行了以下探究:
,Ka=1.8×10-4),通常情況下是一種無色易揮發的液體。甲酸在濃硫酸作用下容易分解產生CO。某化學興趣小組的同學對HCOOH的性質進行了以下探究:
I、該組同學選擇如圖1所示的裝置探究HCOOH在濃硫酸作用下分解產生了CO,請完成下列各小題。
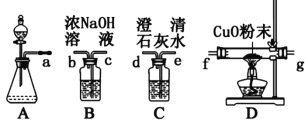

圖1 圖2
⑴寫出甲酸分解的化學方程式 ;
⑵裝置的連接順序a ;
⑶HCOOH的分解產物中有CO的現象 ;
⑷該實驗設計有一處明顯的缺陷是 ;
II、該組同學分析了甲酸分子結構后,認為甲酸能發生銀鏡反應,并設計了如圖2所示的實驗。
⑸依圖所示的實驗,加熱20分鐘后并沒有出現光亮的銀鏡。請解釋實驗中沒有產生銀鏡的原因 ;
⑹請設計實驗來驗證你的解釋 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com