
(2)Xe的原子序數為54,Xe核外M層和N層的電子數分別為______________和____________。
(3)高氙酸鈉(Na4XeO6)用于分析錳、鈰和鉻等元素,顯示有突出的優越性,例如高氙酸鈉在酸性溶液中能將Mn2+氧化成MnO![]() ,生成XeO3。高氙酸鈉在水溶液中已發生了如下反應:Na4XeO6+H2O══NaOH+Na3HXeO6,請寫出高氙酸鈉溶液和硫酸錳的硫酸水溶液反應的離子方程式:________________,若有1 mol Na4XeO6參加反應,轉移電子_________mol。
,生成XeO3。高氙酸鈉在水溶液中已發生了如下反應:Na4XeO6+H2O══NaOH+Na3HXeO6,請寫出高氙酸鈉溶液和硫酸錳的硫酸水溶液反應的離子方程式:________________,若有1 mol Na4XeO6參加反應,轉移電子_________mol。
(1)Na4XeO6+2H2SO4(濃) ══XeO4↑+2Na2SO4+2H2O
XeO4══Xe+2O2
(2)18 18
(3)5HXeO![]() +2Mn 2++9H+══2MnO
+2Mn 2++9H+══2MnO![]() +5XeO3+7H2O 2
+5XeO3+7H2O 2
解析:(1)從Na3XeO4![]() XeO4的變化中,無化合價升降,應考慮復分解反應。(2)應將稀有氣體的原子序數、位置、結構特點熟練記憶。在推斷原子序數較大的元素時顯得尤為重要。(3)要注意題給信息:氙在溶液中存在形式為HXeO
XeO4的變化中,無化合價升降,應考慮復分解反應。(2)應將稀有氣體的原子序數、位置、結構特點熟練記憶。在推斷原子序數較大的元素時顯得尤為重要。(3)要注意題給信息:氙在溶液中存在形式為HXeO![]() ,又是酸性條件下的反應,而得失電子守恒是配平離子方程式的關鍵。會正確解讀配平的離子方程式,這是計算電子轉移的前提。本題將離子反應、氧化還原、化學計算融為一體,較好地考查考生的綜合應變能力。
,又是酸性條件下的反應,而得失電子守恒是配平離子方程式的關鍵。會正確解讀配平的離子方程式,這是計算電子轉移的前提。本題將離子反應、氧化還原、化學計算融為一體,較好地考查考生的綜合應變能力。


科目:高中化學 來源: 題型:
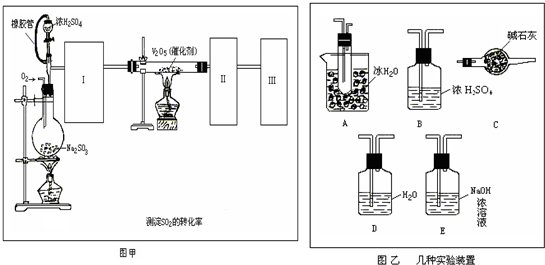
a-
| ||
| a |
a-
| ||
| a |
查看答案和解析>>
科目:高中化學 來源: 題型:

| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半徑/10-10m | 0.73 | 1.36 | 1.34 | 1.06 | 0.99 | 1.54 | 0.75 | 1.02 |
| 最高或最低化合價 | +2 | +1 | +5 | +7 | +1 | |||
| -2 | -3 | -2 |
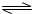 HClO+OH-
HClO+OH-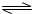 HClO+OH-
HClO+OH-查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
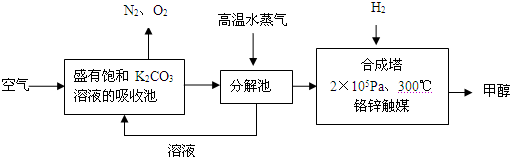
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
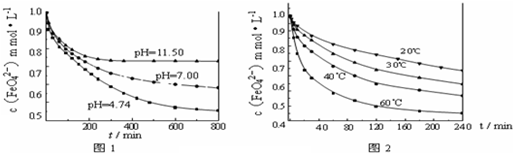
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com