
【題目】反應C(s)+H2O(g)![]() CO(g)+H2(g)在密閉容器中進行,下列條件的改變對其反應速率幾乎無影響的是:( )
CO(g)+H2(g)在密閉容器中進行,下列條件的改變對其反應速率幾乎無影響的是:( )
①升溫 ②增加C的量 ③將容器的體積縮小一半 ④保持體積不變,充入He使體系壓強增大 ⑤保持壓強不變,充入He使容器體積變大
A. ②④ B. ②③ C. ①③ D. ①⑤
科目:高中化學 來源: 題型:
【題目】在10L容器中進行如下反應:A(g)+B(g)![]() 2C(g),2分鐘后,B由2mol減少到1.2mol,則用單位內A的濃度變化表示的反應速率(VA)是 ( )
2C(g),2分鐘后,B由2mol減少到1.2mol,則用單位內A的濃度變化表示的反應速率(VA)是 ( )
A.0.02mol/(L·min)B.0.04mol/(L·min)
C.0.08mol/(L·min)D.0.8mol/(L·min)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示的裝置,C、D、E、F、X、Y都是惰性電極。將電源接通后,向(乙)中滴入酚酞溶液,在F極附近顯紅色。則下列說法正確的是( )

A.電源B極是正極
B.(甲)(乙)裝置的C、D、E、F電極均有單質生成,其物質的量之比為1∶2∶2∶1
C.欲用(丙)裝置給銅鍍銀,H應該是Ag,電鍍液是AgNO3溶液
D.裝置(丁)中Y極附近紅褐色變深,說明氫氧化鐵膠粒帶正電荷
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】反應C2H6(g)![]() C2H4(g)+H2(g) △H>0,在一定條件下于密閉容器中達到平衡。下列各項措施中,不能提高乙烷平衡轉化率的是( )
C2H4(g)+H2(g) △H>0,在一定條件下于密閉容器中達到平衡。下列各項措施中,不能提高乙烷平衡轉化率的是( )
A. 增大容器容積B. 升高反應溫度
C. 分離出部分氫氣D. 等容下通入惰性氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖中反應①是制備SiH4的一種方法,其副產物MgCl2·6NH3是優質的鎂資源。回答下列問題:

(1)MgCl2·6NH3所含元素的簡單離子半徑由小到大的順序(H-除外):_________________________,Mg在元素周期表中的位置:_____________________,Mg(OH)2的電子式:____________________。
(2)A2B的化學式為_______________。反應②的必備條件是_______________。上圖中可以循環使用的物質有_______________。
(3)在一定條件下,由SiH4和CH4反應生成H2和一種固體耐磨材料_______________(寫化學式)。
(4)為實現燃煤脫硫,向煤中加入漿狀Mg(OH)2,使燃燒產生的SO2轉化為穩定的Mg化合物,寫出該反應的化學方程式:_______________。
(5)用Mg制成的格氏試劑(RMgBr)常用于有機合成,例如制備醇類化合物的合成路線如下:
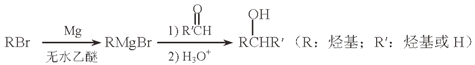
依據上述信息,寫出制備![]() 所需醛的可能結構簡式:_______________。
所需醛的可能結構簡式:_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關化學用語的描述不正確的是( )
A. MgF2的電子式:![]()
B. 中子數為15的硅原子:![]()
C. 次氯酸的結構式:H—Cl—O
D. NH3·H2O的電離方程式:NH3·H2O![]() NH4++OH—
NH4++OH—
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】CO(g)+ H2O(g)![]() CO2(g) + H2(g) △H<0,反應達到平衡后,為提高CO的轉化率,下列措施中正確的是( )
CO2(g) + H2(g) △H<0,反應達到平衡后,為提高CO的轉化率,下列措施中正確的是( )
A.降低溫度B.增加壓強C.用高效催化劑D.增大CO 的濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室需要配制0.50 mol/LNaCl溶液480 mL。按下列操作步驟填上適當的文字,以使整個操作完整。
(1)選擇儀器。完成本實驗所必需的儀器有:托盤天平(精確到0.1 g)、藥匙、燒杯、玻璃棒、________、________以及等質量的兩片濾紙。
(2)計算稱量。配制該溶液需稱取NaCl晶體________g。
(3)溶解、冷卻,該步實驗中需要使用玻璃棒,目的是___________。
(4)轉移、洗滌。
(5)向容量瓶中加入蒸餾水,直到液面離刻度線約1-2厘米時,改用___________滴加蒸餾水至液面與刻度線相切。蓋好瓶塞,搖勻。如果加水時液面超過刻度線,將使配得的溶液濃度___________(填“偏高”、“偏低”或“無影響”)。
(6)將配好的溶液靜置一段時間后,倒入指定的試劑瓶,并貼好標簽,注明配制的時間、溶液名稱及濃度。
(7)在配制過程中,某學生觀察定容時液面情況如圖所示,所配溶液的濃度會________(填“偏高”、“偏低”或“無影響”)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知下列數據:
化學鍵 | H-H | N≡N |
鍵能/kJ·mol-1 | 435 | 943 |
如圖是N2(g)和H2(g)反應生成1molNH3(g)過程中能量變化示意圖,試根據表中及圖中數據計算N-H的鍵能______________。

(2)肼可作為火箭發動機的燃料,與氧化劑N2O4反應生成N2和水蒸氣。
已知:①N2(g)+2O2(g)=N2O4(l) ΔH1=-19.5 kJ·mol-1
②N2H4(l)+O2(g)=N2(g)+2H2O(g) ΔH2=-534.2 kJ·mol-1
寫出肼和N2O4反應的熱化學方程式______________________________。
(3)若用標準狀況下4.48LO2氧化N2H4至N2,整個過程中轉移的電子總數為___________(阿伏加德羅常數用NA表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com