
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:學習周報 化學 人教課標高二版(選修4) 2009-2010學年 第3期 總第159期 人教課標版(選修4) 題型:022
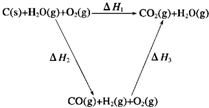
將煤轉化為水煤氣是通過化學方法將煤轉化為潔凈燃料的方法之一.煤轉化為水煤氣的主要反應為:
C+H2O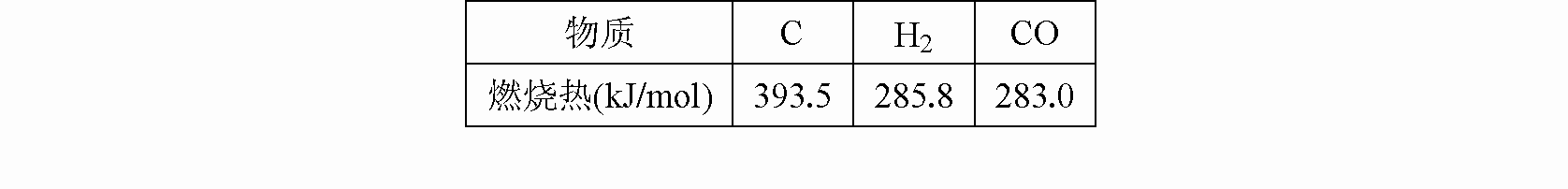
已知:
1 mol H2O(g)轉化為1 mol H2O(l)放出44.0 kJ的熱量.回答下列問題:(1)寫出C不完全燃燒的熱化學方程式:________.
(2)現有H2或CO為燃料提供熱能,你認為應該選擇________(填寫序號);
a.H2 b.CO c.均可以理由是________.
(3)甲同學根據1 mol CO(g)和1 mol H2(g)完全燃燒放出的熱量總和比1 mol C(s)完全燃燒放出的熱量多,認為:“煤燃燒時加少量水,可以使煤燃燒放出更多的熱量.”乙同學根據蓋斯定律寫出下列循環圖:
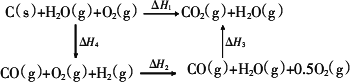
據此,乙同學認為:“將煤轉化為水煤氣再燃燒放出的熱量與直接燃燒煤放出的熱量一樣多,而將煤轉化為水煤氣會增加生產環節、增加消耗,因此,將煤轉化為水煤氣得不償失.”請你對甲、乙兩同學的觀點的正確性進行評價并闡述你的理由:
________.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com