
| A. | BaSO4的溶解度增大,Ksp不變 | B. | BaSO4的溶解度、Ksp均增大 | ||
| C. | BaSO4的溶解度、Ksp均不變 | D. | BaSO4的溶解度不變,Ksp增大 |
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol任何氣體的體積都約是22.4L | |
| B. | lmolH2和O2的混合氣體,在標準狀況下的體積約為22.4L | |
| C. | lmol H2氣態物質,當體積為22.4L時,該氣體一定處于標準狀況 | |
| D. | 標準狀況下,2molH2O體積約為44.8L |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
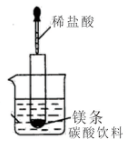 (1)如圖所示(夾持儀器省去),把試管放入盛有20℃碳酸飲料的燒杯中,試管中開始放入幾塊鎂條,再用滴管滴加5ml的鹽酸于試管中.
(1)如圖所示(夾持儀器省去),把試管放入盛有20℃碳酸飲料的燒杯中,試管中開始放入幾塊鎂條,再用滴管滴加5ml的鹽酸于試管中.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
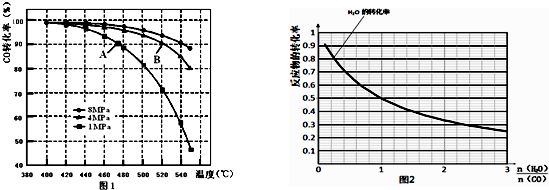
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
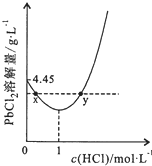 20℃時,PbCl2(s)在不同濃度鹽酸中的最大溶解量(單位:g•L-1)如圖所示.下列敘述正確的是( )
20℃時,PbCl2(s)在不同濃度鹽酸中的最大溶解量(單位:g•L-1)如圖所示.下列敘述正確的是( )| A. | 鹽酸濃度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能與一定濃度的鹽酸反應 | |
| C. | x、y兩點對應的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入過量濃鹽酸,可將Pb2+完全轉化為PbCl2(s) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
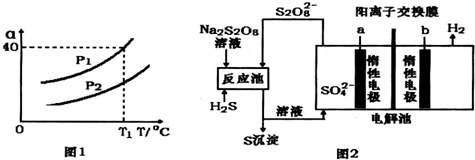
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| CO濃度(mol•L-1) | H2濃度(mol•L-1) | 逆反應速率(mol•L-1•min-1) |
| 0.1 | c1 | 9.6 |
| c2 | c1 | 19.2 |
| c2 | 0.3 | 64.8 |
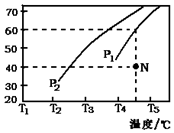
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
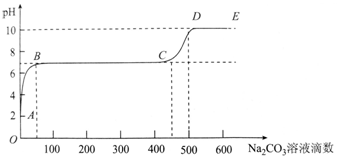
| A. | 開始時溶液pH=2是因為殘留液中還有鹽酸剩余 | |
| B. | BC段表示隨著碳酸鈉溶液的滴入,CaCO3沉淀的質量逐漸增加 | |
| C. | 滴入500滴碳酸鈉溶液后溶液中c(OH-)>c(H+) | |
| D. | AB發生的反應為:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com