
分析 (1)根據配制一定物質的量濃度的溶液的操作步驟判斷:在配制物質的量濃度的溶液時,要經過:計算→稱量→溶解→移液、洗滌→振蕩→定容→搖勻等步驟;
(2)高錳酸鉀具有強氧化性,能氧化堿式滴定管乳膠;滴定終點時,高錳酸鉀稍過量,此時溶液出現淺紅色半分鐘不褪色;滴定發生的是氧化還原反應,稀釋不影響滴定結果;
(3)鋅粉能與Fe3+反應,加入鋅粉的目的是將Fe3+恰好還原成Fe2+;
(4)根據物質的性質和書寫離子方程式的有關要求書寫離子方程式;
(5)根據離子方程式計算晶體中鐵的質量分數;若在步驟二中滴入酸性高錳酸鉀溶液不足,則會有部分草酸根離子未被氧化,在步驟三中則會造成消耗酸性高錳酸鉀溶液的量偏大,從而計算出的鐵的量增多,含量偏高.
解答 解:(1)在配制物質的量濃度的溶液時,要經過:計算→稱量→溶解→移液、洗滌→振蕩→定容→搖勻等步驟;
故答案為:溶解;定容;
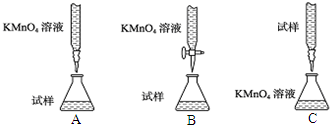
(2)高錳酸鉀具有強氧化性,能氧化堿式滴定管乳膠,故選用酸式滴定管盛放高錳酸鉀溶液;滴定終點時,高錳酸鉀稍過量,此時溶液出現淺紅色半分鐘不褪色;滴定發生的是氧化還原反應,稀釋不影響滴定結果;
故答案為:B;堿式滴定管乳膠易被腐蝕;出現淺紅色半分鐘不褪色;無影響;
(3)加入鋅粉的目的是將Fe3+恰好還原成Fe2+,使Fe2+在步驟三中與KMnO4發生氧化還原反應;
故答案為:將Fe3+恰好還原成Fe2+;
(4)在步驟二中高錳酸鉀氧化草酸跟生成CO2,的離子反應為:5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H+═2Mn2++8H2O+10CO2↑;在步驟三中高錳酸鉀氧化Fe2+生成Fe3+,離子反應為:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,
故答案為:5C2O${\;}_{4}^{2-}$+2MnO${\;}_{4}^{-}$+16H+═2Mn2++8H2O+10CO2↑;5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;
(5)根據步驟三中的離子反應可知:n(Fe)=5n(MnO4-)=5×$\frac{20.02mL+19.98mL}{2}$×0.01 mol•L-1×10-3×20=2.0×10-2mol,m(Fe)=56 g•mol-1×2.0×10-2mol=1.12g.晶體中鐵的質量分數=$\frac{1.12g}{10g}$×100%=11.2%,若在步驟二中滴入酸性高錳酸鉀溶液不足,則會有部分草酸根離子未被氧化,在步驟三中則會造成消耗酸性高錳酸鉀溶液的量偏大,從而計算出的鐵的量增多,含量偏高;
故答案為:11.2%;偏高.
點評 本題考查較為綜合,涉及到溶液的配制、滴定和結晶等操作,注意基礎實驗知識的積累,把握實驗步驟、原理和注意事項等問題,題目難度中等.


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:選擇題
| A. | 每摩爾Si晶體中,含有2摩爾Si-Si共價鍵 | |
| B. | 在CO2晶體中,與每個CO2分子周圍緊鄰的有12個CO2分子 | |
| C. | 在CsCl晶體中,與每個Cs+周圍緊鄰的有8個Cl-,而與每個Cs+等距離緊鄰的也有8個Cs+ | |
| D. | 在金剛石晶體中,最小碳原子環含有6個碳原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某溫度下,在2L密閉容器中X、Y、Z三種氣體進行反應,其物質的量隨時間的變化曲線如圖.
某溫度下,在2L密閉容器中X、Y、Z三種氣體進行反應,其物質的量隨時間的變化曲線如圖.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在一定溫度下,4L密閉容器內存在反應2N?M,其中氣體M、氣體N的物質的量隨時間變化的曲線如圖所示:
在一定溫度下,4L密閉容器內存在反應2N?M,其中氣體M、氣體N的物質的量隨時間變化的曲線如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol碳正離子(CH3+)所含的電子總數為8NA | |
| B. | 1mol甲基(-CH3)所含的電子總數為9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有碳碳雙鍵數為NA | |
| D. | 標準狀況下,1L庚烷完全燃燒所生成的氣態產物的分子數為$\frac{7}{22.4}$NN |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 實驗編號 | T/K | 大理石規格 | HNO3濃度/mol•L-1 |
| ① | 298 | 塊狀 | 2.00 |
| ② | |||
| ③ | 308 | 塊狀 | 2.00 |
| ④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com