
(15分)
某溫度時,在2L密閉容器中氣態物質X和Y反應生成氣態物質Z,它們的物質的量隨時間的變化如表所示。
(1)根據下表中數據,在答題卡該題相應位置上畫出X、Y、Z的物質的量(n)隨時間(t)變化的曲線:
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.20 |
| 3 | 0.75 | 0.50 | 0.50 |
| 5 | 0.65 | 0.30 | 0.70 |
| 9 | 0.55 | 0.10 | 0.90 |
| 10 | 0.55 | 0.10 | 0.90 |
| 14 | 0.55 | 0.10 | 0.90 |

(2)體系中發生反應的化學方程式是___________________________;
(3)列式計算該反應在0-3min時間內產物Z的平均反應速率:_______________;
(4)該反應達到平衡時反應物X的轉化率a等于___________________________;
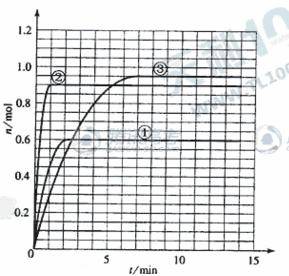
(5)如果該反應是放熱反應。改變實驗條件(溫度、壓強、催化劑)得到Z隨時間變化的曲線1、2、3(如右圖所示)則曲線1、2、3所對應的實驗條件改變分別是:
①_________________ ②_______________ ③__________________
 優質課堂快樂成長系列答案
優質課堂快樂成長系列答案科目:高中化學 來源:2011-2012學年江蘇省射陽中學高二上學期期末考試化學(選修)試卷 題型:填空題
(每空格3分,計15分)某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)分解反應平衡常數和水解反應速率的測定。
將一定量純凈的氨基甲酸銨置于特制的密閉真空容器中(假設容器體積不變,固體試樣體積忽略不計),在恒定溫度下使其達到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
實驗測得不同溫度下的平衡數據列于下表:
| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
 B.密閉容器中總壓強不變
B.密閉容器中總壓強不變查看答案和解析>>
科目:高中化學 來源:2012屆浙江省紹興一中高三5月模擬考試理科綜合化學試卷(帶解析) 題型:填空題
(15分)氨基磺酸(H2NSO3H)是一元固體強酸,溶于水和液氨,不溶于乙醇,在工業上用作酸性清洗劑、阻燃劑、磺化劑等。市售商品為白色粉末,在常溫下,只要保持干燥不與水接觸,固體的氨基磺酸不吸濕,比較穩定。它具有不揮發、無臭味和對人體毒性極小的特點。某實驗組用尿素和發煙硫酸(溶有SO3的硫酸)為原料合成氨基磺酸的路線如下 “磺化”步驟中所發生的反應為:
①CO(NH2)2(s) + SO3(g)  H2NCONHSO3H(s) △H<0
H2NCONHSO3H(s) △H<0
②H2NCONHSO3H + H2SO4 2H2NSO3H + CO2↑
2H2NSO3H + CO2↑
(1)下圖是“磺化”過程的實驗裝置,恒壓滴液漏斗的作用是 ____________
(2)抽濾時,所得晶體要用溶劑乙醇洗滌,則洗滌的具體操作是
(3)實驗過程的討論分析:
①重結晶時用溶劑甲(10%~12%的硫酸)作重結晶的溶劑用而不用水作溶劑的原因是
② “磺化”過程溫度與產率的關系如圖(1),控制反應溫度為75~80℃為宜,若溫度高于80℃,氨基磺酸的產率會降低,原因是 。
(4)測定產品中氨基磺酸純度的方法如下:稱取7.920g產品配成l000mL待測液,量取25.00mL待測液于錐形瓶中,加入2mL 0.2000mol·L-1稀鹽酸,用淀粉碘化鉀試劑作指示劑,逐滴加入0.08000mol·L-1NaNO2溶液,當溶液恰好變藍時,消耗NaNO2溶液25.00mL,此時氨基磺酸恰好被完全氧化成N2,NaNO2的還原產物也為N2。
①以酚酞為指示劑,用NaOH進行酸堿中和滴定也能測定產品中氨基磺酸的純度,測定結果通常比NaNO2法偏高,原因是氨基磺酸中混有 _____ 雜質。
②寫出NaNO2滴定法中的化學方程式為: 。
③試求產品中氨基磺酸的質量分數__________________________。
查看答案和解析>>
科目:高中化學 來源:2010年西藏拉薩中學高三下學期第七次月考(理綜)化學部分 題型:實驗題
(15分)現用下圖所示裝置及所給藥品探究工業制硫酸時二氧化硫的轉化率。已知C中含硫酸n mol,設氣體進入C和D時能分別完全吸收某一種氣體,且忽略裝置內空氣中的CO2。

請回答下列問題:
(1)檢查完裝置的氣密性且加入藥品后,開始進行時首先應進行的操作是
。
(2)通過觀察中氣泡的逸出速率可控制SO2和O2的流量和體積比,A裝置還起的作用有 。
(3)為了提高測定SO2轉化率的準確度,下列操作或改進可行的是(填序號) 。
①熄滅酒精燈后,停止通入SO2,繼續通入O2一段時間
②熄滅酒精燈后,停止通入O2,繼續通入SO2一段時間
③在C、D之間加裝一個盛有濃硫酸的洗氣瓶
(4)若氣體經過充分,實驗結束后,稀釋裝置C中的溶液,并向其中加入足量的BaCl2溶液,得到的沉淀質量為w g。若裝置D增加的質量為a g,則二氧化硫的轉化率是:
(用含字母的代數式表示,結果可不化簡)。
(5)若向接觸室中通入2 molSO2(g)和1molO2(g),在一定溫度下,反應達到平衡時測得接觸室內的壓強為起始時的0.75倍,則SO2的轉化率為 ;相同條件下,當起始時同時通入a mol SO2、b mol O2、c mol SO3(g)時,達到平衡時與原平衡等效,且起始時維持化學反應向逆反應方向進行,則c的取值范圍為 。
查看答案和解析>>
科目:高中化學 來源: 題型:
(15分)(1)右圖是![]() 和
和![]() 反應生成
反應生成![]() 和
和![]() 過程中能量變化示意,請寫出
過程中能量變化示意,請寫出![]() 和
和![]() 反應的熱化學方程式_________________________________。
反應的熱化學方程式_________________________________。
(2)已知下列熱化學方程式:
![]()
![]() =-393.5 kJ?mol-1
=-393.5 kJ?mol-1
![]()
![]() =-483.6 kJ?mol-1
=-483.6 kJ?mol-1
![]()
![]() =-283.0 kJ?mol-1
=-283.0 kJ?mol-1
由此可知反應:![]() 9
9![]() 的焓變為_________。
的焓變為_________。
 (3)某溫度時
(3)某溫度時![]() 在水中的沉淀溶解平衡曲線如同所示。(提示
在水中的沉淀溶解平衡曲線如同所示。(提示![]() ⇋
⇋![]() (aq)的平衡稈數
(aq)的平衡稈數![]() ?
?![]() ,稱為溶度積常數。)下列說法正確的是_____(填字母序號)。
,稱為溶度積常數。)下列說法正確的是_____(填字母序號)。
A.加入![]() 可以使溶液由a點變到b點
可以使溶液由a點變到b點
B.通過蒸發可以使溶液由d點變到c點
C.d點無![]() 沉淀生成
沉淀生成
D.a點對應的![]() 等于c點對應的
等于c點對應的![]()
(4)在一固定體積的密閉容器中,進行如下化學反應:
![]()
![]() <0,其化學平衡常數K與t關系如下表:
<0,其化學平衡常數K與t關系如下表:
t/K | 298 | 398 | 498 | …… |
K/(mol?L | 4.1× | K | K | …… |
請完成下列問題:
①試比較K![]() 、K
、K![]() 的大小,K1_______K2(填寫“>”“=”或“<”)
的大小,K1_______K2(填寫“>”“=”或“<”)
②下列各項能作為判斷浚反應達到化學平衡狀態的依據的是__________(填字母序號)。
A.容器內![]() 、
、![]() 、
、![]() 的濃度之比為1:3:2 B.
的濃度之比為1:3:2 B. ![]()
C.容器內坼強保持不變 D.混合氣體的密度保持不變
E.混合氣體的平均相對分子質量不再改蠻 E.混合氣體中各成分的濃度不再改變
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com