
【題目】工業上真空煉銣的原理為2RbCl+Mg ![]() MgCl2+2Rb(g),下列說法正確的是
MgCl2+2Rb(g),下列說法正確的是
A. 鎂的金屬活動性比銣強,故鎂可置換銣
B. 銣的沸點比鎂低,把銣蒸氣抽出時,平衡右移
C. MgCl2的熱穩定性比RbCl弱
D. Rb單質比RbCl更穩定
科目:高中化學 來源: 題型:
【題目】I.工業上可由氫氣、氮氣合成氨氣,溶于水形成氨水。鹽酸和氨水是實驗室常見的電解質溶液。一定溫度下,向2L 密閉容器中加入N2(g)和H2(g),發生反應:N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0), NH3物質的量隨時間的變化如右圖所示。
2NH3(g)+ Q(Q>0), NH3物質的量隨時間的變化如右圖所示。

(1)0~2 min 內的平均反應速率 v(H2)=___________。
(2)該溫度下,反應 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)的平衡常數表達式K=______。其平衡常數K與溫度T的關系如下表:
2NH3(g)+ Q(Q>0)的平衡常數表達式K=______。其平衡常數K與溫度T的關系如下表:
T/ ℃ | 25 | 125 | 225 |
平衡常數 K | 4×106 | K1 | K2 |
試判斷K1________K2(填寫“>”“=”或“<”)。
(3)下列能說明合成氨反應已達到平衡狀態的是______(填字母)(反應是在固定體積的密閉容器中進行的)
a.3v(N2) = v(H2)
b.容器內壓強保持不變
c.混合氣體的密度保持不變
d.25℃時,測得容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1
II.常溫下,某同學將鹽酸與氨水等體積混合,兩種溶液的濃度和混合后所得溶液的pH 如下表。
實驗編號 | 氨水濃度/mol·L-1 | 鹽酸濃度/mol·L-1 | 混合溶液 pH |
① | 0. 2 | 0.2 | pH=x |
② | c | 0.2 | pH=7 |
請回答:
(4)①中所得混合溶液, pH_______7(填“>”“<”或“=”)。
②中 c___0.2(填“>”“<”或“=”),所得混合溶液中各離子濃度大小關系為_____________。
(5)請你再設計一個能證明一水合氨是弱電解質的方案。_____________。
【答案】 0.375 mol/(L·min) [NH3]2/[N2][H2]3 > bd < > [Cl-]= [NH4+]> [H+]= [OH-] 測量 0.1mol/L 氨水的 pH,pH小于13 等
【解析】試題分析:I.(1)根據![]() 計算反應速率;(2)根據平衡常數的定義書寫平衡常數表達式;反應 N2(g)+3H2(g)
計算反應速率;(2)根據平衡常數的定義書寫平衡常數表達式;反應 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反應放熱,升高溫度平衡逆向移動;(3)根據平衡狀態的特征分析;II. (4)①等濃度、等體積的鹽酸和氨水混合,恰好反應生成氯化銨,氯化銨是強酸弱堿鹽,銨根離子水解;②若等濃度、等體積的鹽酸和氨水混合,溶液呈酸性,要使pH=7,則氨水的物質的量大于鹽酸;根據電荷守恒分析離子濃度關系;(5)根據弱電解質部分電離或弱堿陽離子能水解設計方案;
2NH3(g)+ Q(Q>0)正反應放熱,升高溫度平衡逆向移動;(3)根據平衡狀態的特征分析;II. (4)①等濃度、等體積的鹽酸和氨水混合,恰好反應生成氯化銨,氯化銨是強酸弱堿鹽,銨根離子水解;②若等濃度、等體積的鹽酸和氨水混合,溶液呈酸性,要使pH=7,則氨水的物質的量大于鹽酸;根據電荷守恒分析離子濃度關系;(5)根據弱電解質部分電離或弱堿陽離子能水解設計方案;
解析:I.(1)2min內生成1mol氨氣,則消耗氫氣1.5mol, ![]() =
=![]() 0.375 mol/(L·min);(2)根據平衡常數的定義,平衡常數K=
0.375 mol/(L·min);(2)根據平衡常數的定義,平衡常數K=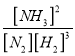 ;反應 N2(g)+3H2(g)
;反應 N2(g)+3H2(g)![]() 2NH3(g)+ Q(Q>0)正反應放熱,升高溫度平衡逆向移動,平衡常數減小,所以K1>K2;(3)a.任意時刻速率比都等于系數比,所以3v(N2) = v(H2)不一定平衡,故a錯誤; b.N2(g)+3H2(g)
2NH3(g)+ Q(Q>0)正反應放熱,升高溫度平衡逆向移動,平衡常數減小,所以K1>K2;(3)a.任意時刻速率比都等于系數比,所以3v(N2) = v(H2)不一定平衡,故a錯誤; b.N2(g)+3H2(g)![]() 2NH3(g),氣體物質的量是變量,所以壓強是變量,容器內壓強保持不變一定達到平衡狀態,故b正確;c.根據
2NH3(g),氣體物質的量是變量,所以壓強是變量,容器內壓強保持不變一定達到平衡狀態,故b正確;c.根據![]() ,氣體密度是恒量, 混合氣體的密度保持不變不一定平衡,故c錯誤;d.25℃時K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,
,氣體密度是恒量, 混合氣體的密度保持不變不一定平衡,故c錯誤;d.25℃時K=4×106,容器中c(NH3)=0.2 mol·L-1, c(H2) =c(N2) =0.01 mol·L-1,  ,Q=K,反應一定達到平衡狀態,故d正確。
,Q=K,反應一定達到平衡狀態,故d正確。
II. (4)①等濃度、等體積的鹽酸和氨水混合,恰好反應生成氯化銨,氯化銨是強酸弱堿鹽,銨根離子水解![]() ,所以溶液呈酸性pH<7;②若等濃度、等體積的鹽酸和氨水混合,溶液呈酸性,要使pH=7,則氨水的物質的量大于鹽酸,所以c>0.2;根據電荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以離子濃度關系為[Cl-]= [NH4+]> [H+]= [OH-];(5)測量 0.1mol/L 氨水的 pH,pH小于13 ,能證明一水合氨部分電離是弱電解質;
,所以溶液呈酸性pH<7;②若等濃度、等體積的鹽酸和氨水混合,溶液呈酸性,要使pH=7,則氨水的物質的量大于鹽酸,所以c>0.2;根據電荷守恒,[Cl-]+[OH-]= [NH4+]+ [H+],溶液呈中性,[OH-]= [H+],所以離子濃度關系為[Cl-]= [NH4+]> [H+]= [OH-];(5)測量 0.1mol/L 氨水的 pH,pH小于13 ,能證明一水合氨部分電離是弱電解質;
點睛:同濃度、同體積的一元強酸與一元弱堿混合,溶液呈酸性;同濃度、同體積的一元弱酸與一元強堿混合,溶液呈堿性;同濃度、同體積的一元強酸與一元強堿混合,溶液呈中性。
【題型】綜合題
【結束】
23
【題目】為了探究鐵、銅及其化合物的性質,某同學設計并進行了下列兩組實驗。
實驗一:

已知:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)
Fe3O4(s)+4H2(g)
(1)虛線框處宜選擇的裝置是________(填“甲”或“乙”);實驗時應先將螺旋狀銅絲加熱,變黑后再趁熱迅速伸入所制得的純凈氫氣中,觀察到的實驗現象是______________________。
(2)實驗后,為檢驗硬質玻璃管中的固體是否含+3價的鐵元素,該同學取一定量的固體并用一定濃度的鹽酸溶解,滴加_______溶液(填試劑名稱或化學式),沒有出現血紅色,說明該固體中沒有+3價的鐵元素。請你判斷該同學的結論是否正確并說明理由_________________。
實驗二:
綠礬是含有一定量結晶水的硫酸亞鐵,為測定綠礬中結晶水含量,將石英玻璃管(帶兩端開關K1和K2(設為裝置A)稱重,記為m1 g。將樣品裝入石英玻璃管中,再次將裝置A 稱重,記為m2 g,B為干燥管。按下圖連接好裝置進行實驗。

實驗步驟如下:(1)________,(2)點燃酒精燈,加熱,(3)______,(4)______,(5)______,
(6)稱量A, 重復上述操作步驟,直至 A 恒重,記為m3 g。
(3)請將下列實驗步驟的編號填寫在對應步驟的橫線上
a.關閉 K1 和 K2 b.熄滅酒精燈 c.打開 K1 和 K2 緩緩通入 N2 d.冷卻至室溫
(4)必須要進行恒重操作的原因是_________________。
(5)已知在上述實驗條件下,綠礬受熱只是失去結晶水,硫酸亞鐵本身不會分解, 根據實驗記錄,
計算綠礬化學式中結晶水數目 x=__________________(用含 m1、 m2、 m3的列式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】溴化鈣醫藥上用作中樞神經抑制藥,具有抑制、鎮靜作用,用以治療神經衰弱、癲癇等癥,在水中極易溶解,溶于乙醇和丙酮。制備溴化鈣晶體(CaBr2·2H2O)的主要流程如下:

(1)檢驗FeBr2中是否含有Fe3+,應選擇________(填字母編號)。
a.NaOH溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液 d.KMnO4溶液
(2)操作②要求控制溫度在40℃,不能過高和過低的原因是_____________________。
(3)要實現Fe粉至FeBr2的轉化,在原料配比時應注意_____________,試劑X的化學式為_______________。
(4)加入熟石灰至出渣的過程中,固體的顏色發生變化,原因是___________(用化學反應方程式表示。)
(5)操作④的步驟為蒸發濃縮、__________、過濾、洗滌、干燥。蒸發濃縮時除酒精燈、三腳架外還需用到儀器有____________。
(6)將氨氣通入石灰乳,加入溴,于65℃進行反應也可制得溴化鈣,此反應中還會生成一種無色無味氣體,寫出反應的化學方程式_____________。
(7)將上述流程中的出渣,經凈化分離得到鐵粉。已知25℃,101kPa時:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=-260kJ/mol
將鐵粉與碳、氧氣共同作用可以得到FeCO3,則該反應的熱化學反應方程式為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】降低發動機中柴油燃燒產生NOx的排放,可利用尿素分解產生的氣體采用選擇性催化還原技術或儲存還原技術來消除污染。
(1)選擇性催化還原技術工作原理為:

①尿素[CO(NH2)2]水溶液熱分解為NH3和CO2,該反應的化學方程式_________。
②用2Kg尿素能處理標準狀況下含NOx(以NO2計)體積分數為7%的尾氣10m3,則該尿素的利用率為_____________。
③將上述尾氣處理原理設計成原電池,在處理了廢氣的同時產生電能,其工作原理如圖所示。則通入NH3的一極為_______________極,通入NOx時發生的電極反應方程式為___________。
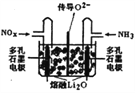
(2)儲存還原技術工作原理為:NOx的儲存和還原在不同時段交替進行,如圖所示。
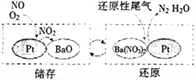
①寫出上圖中儲存NO時發生的反應總方程式________________________。
②還原過程中,有時會產生笑氣(N2O)。用同位素示蹤法研究發現笑氣的產生與NO有關。在有氧條件下15NO與NH3以一定比例反應時,得到的笑氣幾乎都是(15N2N)2O3。將該反應的化學方程式補充完整:________![]() 口(15N2N)2O3+口H2O
口(15N2N)2O3+口H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬鎳具有優良的物理和化學特性,是高技術產業的重要原料.
羰基法提純鎳涉及的反應為:Ni(s)+4CO(g)Ni(CO)4(g)
①當溫度升高時, ![]() 減小,則△H0(填“>”或“<”).
減小,則△H0(填“>”或“<”).
②一定溫度下,將一定量的粗鎳和CO加入一恒壓密閉容器中,下列示意圖正確且能說明反應達到平衡狀態的是(填代號)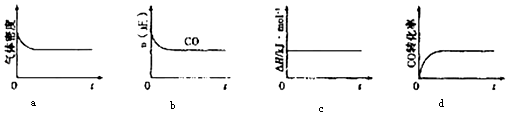
在相同溫度下,上述反應改在體積為1L的恒容密閉容器中進行,平衡常數(填“增大”、“不變”或“減小”),反應進行3s后測得Ni(CO)4的物質的量為0.6mol,則0﹣3s內的平均反應速率v(CO)= .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質與其用途相符合的是
①Cl2——做消毒劑 ②AgBr——制膠卷,感光紙 ③AgI——人工降雨
④加碘食鹽——預防甲狀腺腫大 ⑤淀粉——檢驗I2的存在 ⑥NaClO——漂白紡織物
A.②③④⑤⑥B.①②③④⑤C.②③④⑤D.全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(10分)在一定條件下可實現下圖所示物質之間的轉化:
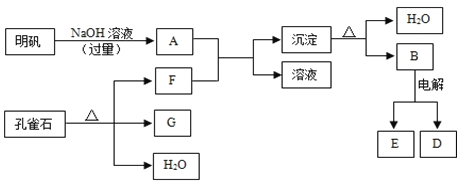
請填寫下列空白:
(1)孔雀石的主要成分是CuCO3·Cu(OH)2(堿式碳酸銅),受熱易分解,圖中的F是______(填化學式)。
(2)寫出明礬溶液與過量NaOH溶液反應的離子方程式: 。
(3)寫出B電解生成E和D的反應方程式: 。
(4)圖中所得G和D都為固體,混合后在高溫下可發生反應,寫出該反應的化學方程式 ,該反應消耗了2 molG,則轉移的電子數是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某校探究學習小組用已部分生銹的廢鐵屑制作印刷電路板的腐蝕劑,并回收銅。探究過程如圖所示:

請回答下列問題:
(1)步驟①中先加入熱的Na2CO3溶液除油污,操作甲的名稱是________。
(2)步驟②中,除發生反應Fe+2HCl===FeCl2+H2↑外,其他可能反應的離子方程式為_______________________________________________________。
(3)溶液C的顏色是________,溶液D中可能含有的金屬陽離子有_______________。
(4)可以驗證溶液B中是否含有Fe2+的一種試劑是______(填選項序號)。
a.稀硫酸 b.鐵c.硫氰化鉀 d.酸性高錳酸鉀溶液
(5)操作乙的名稱是________,步驟⑤產生金屬銅的化學方程式為_______________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】①②③④⑤五種元素,在元素周期表中的位置如圖所示.回答下列問題:
(1)上述五種元素中,金屬性最強的元素在周期表中的位置是 , 該元素的單質在空氣中燃燒的化學方程為 .
(2)元素①和③可以形成眾多的化合物,其中最簡單的是(寫化學式) , 該化合物中,化學鍵的類型為(填“離子鍵”或“共價鍵”).
(3)試用電子式表示元素⑤單質分子的形成過程 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com