
【題目】一定溫度下,在2 L的恒容密閉容器中發生反應![]() 。反應過程中的部分數據如下表所示:
。反應過程中的部分數據如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列說法正確的是( )
A.0~5 min用A表示的平均反應速率為![]()
B.該反應在10 min后才達到平衡
C.平衡狀態時,![]()
D.物質B的平衡轉化率為20%
【答案】C
【解析】
A.v(C)= ,同一反應反應中反應速率之比等于計量數之比,3v(A)=v(C),所以v(A)=
,同一反應反應中反應速率之比等于計量數之比,3v(A)=v(C),所以v(A)=![]() ,故A錯誤;
,故A錯誤;
B.15min時,n(B)=1.6mol,消耗了2.4mol-1.6mol=0.8mol,根據方程式可知這段時間內消耗A的物質的量為0.4mol,所以15min時,n(A)=1.6mol,與10min時A的物質的量相同,說明10~15min這段時間內平衡沒有移動,但無法確定是10min時達到平衡,還是10min前已經達到平衡,故B錯誤;
C.根據B選項分析可知平衡時消耗的B為0.8mol,根據方程式可知生成C的物質的量為1.2mol,濃度為![]() ,故C正確;
,故C正確;
D. 物質B的平衡轉化率為![]() ,故D錯誤;
,故D錯誤;
故答案為C。


 智趣暑假溫故知新系列答案
智趣暑假溫故知新系列答案 英語小英雄天天默寫系列答案
英語小英雄天天默寫系列答案 暑假作業安徽少年兒童出版社系列答案
暑假作業安徽少年兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】下列物質中氧原子數目與6.8gH2O2中氧原子數目一定相等的是( )
A.6.72 L COB.6.6 g CO2C.8 g SO3D.9.8 g H2SO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學在環境保護中起著十分重要的作用,電化學降解法可用于治理水中硝酸鹽的污染。電化學降解NO3-的原理圖所示。下列說法不正確的是:
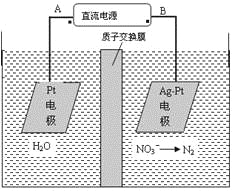
A.A為電源正極
B.陽極反應式為:2H2O-4e-=4H++O2↑
C.若電解過程中轉移了2mol電子,則膜兩側電解液的質量變化差(Δm左-Δm右)為10.4克
D.陰極反應式為:2NO3-+6H2O+10e-=N2↑+12OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生活密切相關,下列說法不正確的是![]()
A.“酸雨”、“臭氧層受損”、“光化學煙霧”都與氮氧化物有關
B.PM2.5作為空氣質量預報的一項重要指標,它是指空氣中直徑小于或等于2.5m的顆粒物,該值越高,代表空氣污染程度越嚴重
C.靜電除塵治理懸浮顆粒污染,其依據是膠體的電泳原理
D.為消除碘缺乏癥,衛生部規定食鹽中必須加含碘物質,食鹽中所加含碘物質是KI
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A.![]() 的溶液不一定呈堿性
的溶液不一定呈堿性
B.中和pH和體積均相等的氨水、![]() 溶液,所需
溶液,所需![]() 的物質的量相同
的物質的量相同
C.相同溫度下,pH相等的鹽酸、![]() 溶液中,
溶液中,![]() 相等
相等
D.氨水和鹽酸反應后的溶液,若溶液呈中性,則![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖為一種廣泛使用的高分子材料助劑的結構簡式,下列說法正確的是( )(CH3CH2CH2CH3可表示為![]()
![]()

A.該有機物的分子式為C24H40O4
B.1mol該有機物與氫氣發生加成反應,最多消耗5mol氫氣
C.該有機物在氫氧化鈉作用下發生水解反應得到三種有機物
D.該有機物在FeBr3存在下與液溴發生取代反應生成兩種一溴代物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】C1O2是一種消毒殺菌效率高、二次污染小的水處理劑。實驗室可通過以下反應制得C1O2:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O,下列說法中正確的是
2ClO2↑+K2SO4+2CO2↑+2H2O,下列說法中正確的是
A. 在反應中H2C2O4既不是氧化劑也不是還原劑
B. 1 mol KClO3參加反應,在標準狀況下能得到22.4 L氣體
C. 1 mol KClO3參加反應有2 mol電子轉移
D. KClO3在反應中是氧化劑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醇脫水是合成烯烴的常用方法,實驗室合成環己烯的反應和實驗裝置如下:
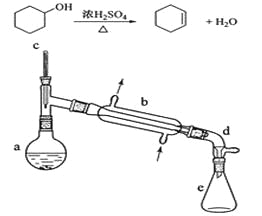
可能用到的有關數據如下:
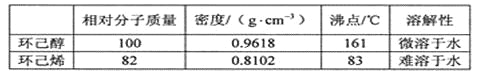
合成反應:
在a中加入20g環己醇和2小片碎瓷片,冷卻攪動下慢慢加入1 mL濃硫酸。B中通入冷卻水后,開始緩慢加熱a,控制餾出物的溫度不超過90℃。
分離提純:
反應粗產物倒入分液漏斗中分別用少量5%碳酸鈉溶液和水洗滌,分離后加入無水氯化鈣顆粒,靜置一段時間后棄去氯化鈣。最終通過蒸餾得到純凈環己烯10g。
回答下列問題:
(1)裝置b的名稱是__________________。
(2)加入碎瓷片的作用是_______________;如果加熱一段時間后發現忘記加瓷片,應該采取的正確操作時_____________(填正確答案標號)。
A.立即補加 B.冷卻后補加 C.不需補加 D.重新配料
(3)本實驗中最容易產生的副產物的結構簡式為_______________________。
(4)分液漏斗在使用前須清洗干凈并____________;在本實驗分離過程中,產物應該從分液漏斗的_________________(填“上口倒出”或“下口放出”)。
(5)分離提純過程中加入無水氯化鈣的目的是______________________________。
(6)在環己烯粗產物蒸餾過程中,不可能用到的儀器有___________(填正確答案標號)。
A.圓底燒瓶 B.溫度計 C.吸濾瓶 D.球形冷凝管 E.接收器
(7)本實驗所得到的環己烯產率是____________(填正確答案標號)。
A.41% B.50% C.61% D.70%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮元素可以形成多種氫化物,如NH3、N2H4等。
(1)工業上,可用次氯酸鈉與氨反應制備N2H4(肼),副產物對環境友好,寫出反應的化學方程式________。
(2)工業上以NH3和CO2為原料合成尿素[CO(NH2)2],反應的化學方程式為:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g),該反應的平衡常數和溫度關系如圖所示:
CO(NH2)2(l)+H2O(g),該反應的平衡常數和溫度關系如圖所示:

①該反應的ΔH_____0(填“>”或“<”)。
②已知原料氣中的氨碳比[![]() ]為x,CO2的平衡轉化率為a,在一定溫度和壓強下,a與x的關系如圖所示。a隨著x的增大而增大的原因是______。圖中A點處,NH3的平衡轉化率為__________。
]為x,CO2的平衡轉化率為a,在一定溫度和壓強下,a與x的關系如圖所示。a隨著x的增大而增大的原因是______。圖中A點處,NH3的平衡轉化率為__________。
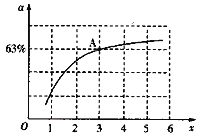
(3)①在氨水加水稀釋的過程中,NH3·H2O的電離程度增大,![]() 的值_______。(填“增大”、“減小”或“不變”,)
的值_______。(填“增大”、“減小”或“不變”,)
②室溫下,amol/L的(NH4)2SO4溶液的pH=5,原因是_____(用離子方程式表示),該反應的平衡常數為______(用含a的數學表達式表示)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com