
【題目】某高聚物的結構簡式如下:
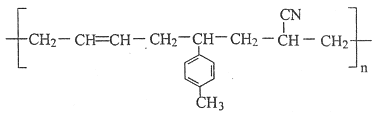
則形成該高分子化合物的單體的結構簡式分別為________。
 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:
【題目】下列敘述正確的有( )
A.第四周期元素中,錳原子價電子層中未成對電子數最多
B.第二周期主族元素的原子半徑隨核電荷數增大依次減小
C.鹵素氫化物中,![]() 的沸點最低的原因是其分子間的范德華力最小
的沸點最低的原因是其分子間的范德華力最小
D.價層電子對互斥理論中,π鍵電子對數不計入中心原子的價層電子對數
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究高效催化劑是解決汽車尾氣中的 NO 和 CO 對大氣污染的重要途徑。
(1)已知:C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol
C(s)+![]() O2(g)= CO(g) △H2= -110.5 kJ/mol
O2(g)= CO(g) △H2= -110.5 kJ/mol
N2(g)+ O2(g)=2NO(g) △H3= +180.0 kJ/mol
則汽車尾氣的催化轉化反應 2NO(g)+ 2CO(g)=N2(g)+ 2CO2(g)的△H =_______kJ/mol。
(2)400℃時,在分別裝有催化劑 A 和 B 的兩個容積為 2 L 的剛性密閉容器中,各充入物質的量均為nmol的NO和CO發生上述反應。通過測定容器內總壓強隨時間變化來探究催化劑對反應速率的影響,數據如下表:
時間/min | 0 | 10 | 20 | 30 | ∞ |
A容器內壓強/kPa | 75.0 | 70.0 | 65.0 | 60.0 | 60.0 |
B容器內壓強/kPa | 75.0 | 71.0 | 68.0 | 66.0 | 60.0 |
①由上表可以判斷催化劑 __________(填“A”或“B”) 的效果更好。
②容器中CO 的平衡轉化率為 __________。400℃時,用壓強表示的平衡常數Kp__________(kPa)-1 (保留兩位小數)。
③汽車尾氣排氣管中使用催化劑可以提高污染物轉化率,其原因是 __________。
(3)為研究氣缸中NO的生成, 在體積可變的恒壓密閉容器中,高溫下充入物質的量均為 1mol 的氮氣和氧氣,發生反應 N2(g)+ O2(g)2NO(g)。
①下列說法能表明該反應已經達到平衡狀態的是_________(填序號)。
A.2v正(O2)= v逆(NO) B.混合氣體的平均相對分子質量不變
C.c(N2):c(O2)=l D.容器內溫度不變
②為減小平衡混合氣中 NO 的體積分數, 可采取的措施是 ___________。
(4)對于缸中NO的生成,化學家提出了如下反應歷程:
第一步 O22O 慢反應
第二步 O+N2NO+N 較快平衡
第三步 N+O2NO+O 快速平衡
下列說法錯誤的是_______(填標號)。
A.第一步反應不從N2分解開始,是因為N2比O2穩定
B.N、O 原子均為該反應的催化劑
C.三步反應中第一步反應活化能最大
D.三步反應的速率都隨溫度升高而增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是H3AsO4水溶液中含砷的各物種分布分數(平衡時某物種的濃度占各物種濃度之和的分數)與pH的關系。下列說法錯誤的是( )
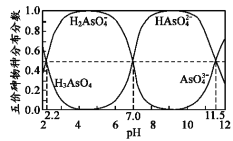
A.NaH2AsO4溶液呈酸性
B.向NaH2AsO4溶液滴加NaOH溶液過程中,c(H2AsO4-)/c(HAsO42-)先增加后減少
C.H3AsO4和HAsO42-在溶液中不能大量共存
D.Ka3(H3AsO4)的數量級為10-12
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗室用乙醇和濃硫酸加熱制取乙烯,實驗裝置如圖,制備過程中,常會看到燒瓶中液體變黑,并有刺激性氣味氣體(SO2)產生。
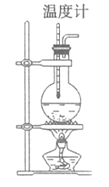
(1)制備乙烯的化學方程式_________。
(2)加熱至140℃時發生副反應,寫出該反應有機產物的結構簡式__________,該反應的反應類型為:__________。
(3)寫出產生SO2的化學方程式:___________。
(4)圖中一處明顯的錯誤是__________,加入碎瓷片的作用是__________。
(5)有人設計下列實驗以確認上述混合氣體中有乙烯和SO2。裝置①、②、③、④可盛放的試劑是①__________;②__________;③品紅;④__________。(填字母)

A. 品紅溶液 B. NaOH溶液 C. 濃H2SO4 D. 酸性KMnO4溶液
(6)實驗(5)中確認含有乙烯的現象是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列涉及化學學科觀點的有關說法正確的是![]()
A. 微粒觀:二氧化硫是由硫原子和氧原子構成的
B. 轉化觀:升高溫度可以將不飽和硝酸鉀溶液轉變為飽和
C. 守恒觀:1g鎂與1g稀硫酸充分反應后所得的溶液質量為2g
D. 結構觀:金剛石和石墨由于結構中碳原子的排列方式不同,性質存在著較大的差異
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】普通水泥在固化過程中其自由水分子減少并形成堿性溶液.根據這一物理化學特點,科學家發明了電動勢法測水泥的初凝時間.此法的原理如圖所示,反應的總方程式為2Cu+Ag2O═Cu2O+2Ag,下列有關說法正確的是( )

A.2molCu與1molAg2O的總能量低于1molCu2O與2molAg具有的總能量
B.負極的電極反應式為2Cu+2OH--2e-═Cu2O+H2O
C.測量原理示意圖中,電流方向從Cu→Ag2O
D.電池工作時,OH-向正極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某學習小組通過下列裝置探究 MnO2與FeCl3·6H2O反應產物。

(查閱資料)FeCl3是一種共價化合物,熔點306℃,沸點315℃。
實驗編號 | 操作 | 現象 |
實驗 1 | 按上圖所示,加熱A中MnO2與FeCl3·6H2O混合物 | ①試管A中固體部分變液態,上方出現白霧 ②稍后,產生黃色氣體,管壁附著黃色液滴 ③試管B中KI-淀粉溶液變藍 |
實驗 2 | 把A中的混合物換為FeCl3·6H2O,B中溶液換為KSCN溶液,加熱。 | A中固體部分變液態,產生白霧和黃色氣體,B中KSCN溶液變紅 |
(實驗探究)實驗操作和現象如下表:
(問題討論)
(1)實驗前首先要進行的操作是______________________________。
(2)實驗1和實驗2產生的白霧是_______(填化學式)溶解在水中形成的小液滴。
(3)請用離子方程式解釋實驗2中黃色氣體使KI-淀粉溶液變藍色的原因_____________。
(4)為確認黃色氣體中含有Cl2,學習小組將實驗1中試管B內KI-淀粉溶液替換為NaBr溶液,發現B中溶液呈橙色,經檢驗無Fe2+,說明黃色氣體中含有Cl2。用鐵氰化鉀溶液檢驗Fe2+的離子方程式是_________________________________。選擇NaBr溶液的原因是________________________________________________________________。
(實驗結論)
(5)實驗1充分加熱后,若反應中被氧化與未被氧化的氯元素質量之比為1:2,則A中發生反應的化學方程式為____________________________________________________。
(實驗反思)
該學習小組認為實驗1中溶液變藍,也可能是酸性條件下,I-被空氣氧化所致,可以先將裝置中的空氣排盡,以排除O2的干擾。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com