
【題目】室溫下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的變化曲線如圖所示。下列說法正確的是

A.a點所示溶液中c(Na+)>c(A-)>c(H+)>c(HA)
B.a、b兩點所示溶液中水的電離程度相同
C.pH=7時,c(Na+)=c(A-)+c(HA)
D.b點所示溶液中c(A-)>c(HA)
【答案】D
【解析】
試題分析:A、a點NaOH與HA物質的量相等,則二者恰好完全反應,生成NaA,反應后溶液的pH為8.7,呈堿性,說明HA為弱酸,NaA發生水解反應,則c(Na+)>c(A-)>c(HA)>c(H+),A錯誤;B、a點NaA發生水解反應,促進了水的電離,所以a點水的電離程度大于b點,B錯誤;C、根據電荷守恒,c(H+)+c(Na+)=c(OH)+c(A-),則pH=7時,c(H+)=c(OH),帶入電荷守恒表達式可得:c(Na+)= c(A-),C錯誤;D、根據圖像可知b點HA過量,因為b點溶液pH=4.7,則溶液呈酸性,故HA的電離程度大于NaA的水解程度,所以c(A-)>c(HA),D正確。答案選D。


科目:高中化學 來源: 題型:
【題目】利用下圖裝置收集氣體并驗證其某些化學性質,正確的是

選項 | 氣體 | 試劑② | 現象 | 結論 |
A | NH3 | 酚酞試液 | 溶液變紅色 | NH3的水溶液顯堿性 |
B | Cl2 | 紫色石蕊試液 | 溶液立即褪色 | Cl2有氧化性 |
C | SO2 | 溴水 | 溶液褪色 | SO2有漂白性 |
D | X(能形成酸雨) | KI淀粉溶液 | 溶液變藍 | X是NO2 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分枝酸可用于生化研究,其結構簡式如圖: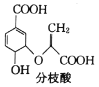 下列關于分枝酸的敘述正確的是( )
下列關于分枝酸的敘述正確的是( )
A.分子中含有2種官能團
B.可與乙醇、乙酸反應,且反應類型相同
C.分枝酸最多可與3mol NaOH發生中和反應
D.可使溴的四氯化碳溶液、酸性高錳酸鉀溶液褪色,且原理相同
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表標出的是元素周期表的一部分元素,用元素符號回答下列問題:
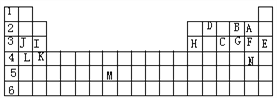
(1)表中用字母標出的14種元素中,化學性質最不活潑的是________,主族元素中金屬性最強的是____,非金屬性最強是 __,常溫下單質為液態的非金屬元素是______;M所在的族是______。
(2)C氣態氫化物的化學式分別為____,A、B、C的氫化物中最穩定的是_______。
(3)第三周期中原子半徑最小的是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】最近美國科學家實施了一項“天空綠色計劃”,通過電解二氧化碳得到碳材料(部分原理如圖所示),并利用得到的碳材料生成鋰離子電池。下列說法正確的是

A. 圖中能量轉化方式只有一種
B. 陽極的電極反應式為2CO32--4e-=2CO2↑+O2↑
C. 若反應中轉移1mole-,則理論上消耗CO32-0.5mol
D. 當生成12g碳材料時,可收集到22.4LO2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應2NO2![]() 2NO+O2在恒容密閉容器中反應,不能判斷此反應達到最大限度的標志是( )
2NO+O2在恒容密閉容器中反應,不能判斷此反應達到最大限度的標志是( )
A. 單位時間內生成n mol O2 的同時,生成2n molNO2 B. 混合氣體的平均相對分子質量不再改變
C. 混合氣體的顏色不再改變 D. NO2, NO, O2的速率之比是2:2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列物質的性質和用途描述錯誤的是
A. 銅質地漏具有獨特的殺菌功能,能較好的抑制細菌生長
B. 明礬溶于水生成氫氧化鋁膠體,起消毒殺菌的作用
C. 鐵粉具有還原性,可用作食品袋內的抗氧化劑
D. 鎂燃燒發出耀眼的白光,可以制造照明彈
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】人們的生活、生產與化學息息相關,下列說法正確的是( )
A. 地溝油主要成分是液態烴,故地溝油經過處理后可作為汽車燃油。
B. 工廠中常用的靜電除塵利用了膠體電泳的性質。
C. 白鐵(鍍鋅鐵)比馬口鐵(鍍錫鐵)鐵板更易腐蝕。
D. 光導纖維的成分是晶體硅。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.某興趣小組利用下圖裝置測定某硫酸工廠排放尾氣中二氧化硫的含量,圖中氣體流量計B用于準確測量通過的尾氣體積。將尾氣通入一定體積已知濃度的碘水中測定SO2的含量。當洗氣瓶C中溶液藍色消失時,立即關閉活塞A。

(1) C中導管末端連接一個多孔球泡D,可以提高實驗的準確度,其理由是_________________。
(2)C中發生反應的離子方程式 。
(3)C中溶液藍色消失后,沒有及時關閉活塞A,測得的SO2含量 (填“偏高”、“偏低”或“無影響”)。
Ⅱ.實驗室常用Na2SO3固體與濃硫酸反應制取SO2 :
(4)現有已制得SO2的飽和溶液,請利用此溶液(其他試劑任選),設計一個簡單實驗,比較SO2與Fe2+ 還原性的強弱(要求:寫出實驗步驟、現象和結論) 。
(5)某研究小組測定部分變質的Na2SO3固體樣品中Na2SO3的含量:
① 取a克Na2SO3固體樣品配制成100mL溶液,取10.00mL該溶液于錐形瓶中,加入幾滴淀粉溶液作指示劑,0.0100mol/L碘水進行滴定,滴定終點現象為 ,記錄數據,重復滴定2次,平均消耗碘水20.00mL。
② 計算:樣品中亞硫酸鈉的質量分數為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com