
| A、78gNa2O2固體中含有的陰離子數為NA |
| B、標準狀況下,2.24L氖氣所含原子數為0.2NA |
| C、1molCl2與足量Fe反應,轉移的電子數為3NA |
| D、標準狀況下,2.24L已烷含有碳原子的數目為0.6NA |
| m |
| M |
| V |
| Vm |
| m |
| M |
| 78g |
| 78g/mol |
| V |
| Vm |
| 2.24L |
| 22.4L/mol |


科目:高中化學 來源: 題型:
| A、增大壓強,使活化分子數目增加,化學反應速率一定增大 |
| B、活化分子間所發生的分子間碰撞均為有效碰撞 |
| C、升高溫度,使活化分子百分數增加,化學反應速率一定增大 |
| D、加入反應物,使活化分子百分數增加,化學反應速率一定增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| ||
| A、Na2O2既是氧化劑又是還原劑 |
| B、3 mol Na2O2發生反應,有6mol電子轉移 |
| C、在Na2FeO4中Fe為+4價,具有強氧化性,能消毒殺菌 |
| D、Na2FeO4既是氧化產物又是還原產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、1molN2所含分子數約為6.02×1023 |
| B、58.5g NaCl所含離子數約為6.02×1023 |
| C、標準狀況下,22.4L H2所含原子數約為6.02×1023 |
| D、常溫常壓下,分子總數約為6.02×1023的SO2的質量是64 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、一定溫度、壓強下,固體的體積只由其分子的大小決定 |
| B、一定溫度、壓強下,氣體體積由其物質的量的多少決定 |
| C、等物質的量濃度的鹽酸和硫酸中,H+的物質的量濃度相等 |
| D、氣體摩爾體積是指1mol任何氣體所占的體積為22.4L |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
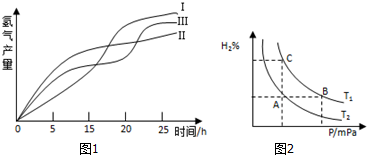
查看答案和解析>>
科目:高中化學 來源: 題型:
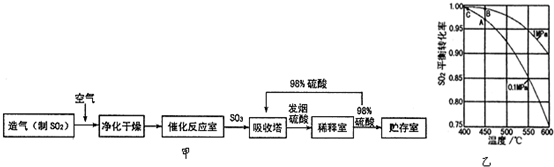
| Q1 |
| 2 |
| Q1 |
| 2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com