
我國化工專家侯德榜的“侯氏制堿法”為世界制堿工業作出了突出貢獻。他利用NaHCO3、NaCl、NH4Cl等物質溶解度的差異,以食鹽、NH3和CO2為原料制得NaHCO3,進而生產出純堿。相關的化學反應有:①NH3+CO2+H2O===NH4HCO3;②NH4HCO3+NaCl===NaHCO3↓+NH4Cl;③2NaHCO3 Na2CO3+CO2↑+H2O↑。某研究性學習小組的同學模擬“侯氏制堿法”,提出下列三種制備NaHCO3的實驗方案。
Na2CO3+CO2↑+H2O↑。某研究性學習小組的同學模擬“侯氏制堿法”,提出下列三種制備NaHCO3的實驗方案。
方案1:分別將CO2和NH3通入到飽和食鹽水中;
方案2:將CO2通入到含NH3的飽和食鹽水中;
方案3:將NH3通入到含CO2的飽和食鹽水中。
(1)經過討論,大家一致認為方案2較合理,請說明方案3的不足之處
________________________________________________________________________。
(2)根據方案2,某同學設計了如下實驗步驟和裝置圖:
步驟1:配制含氨的飽和食鹽水。在100 mL錐形瓶中加入20 mL氨水(體積比1∶1),再加入8 g食鹽,塞緊橡皮塞,振蕩幾分鐘,過濾除去不溶物,得到含氨的飽和食鹽水。
步驟2:制備NaHCO3。按圖組裝實驗裝置,先檢查裝置的氣密性,再向各儀器中加入相應的試劑制備NaHCO3。實驗過程中,需要控制溫度在30~35 ℃(大于35 ℃時NH4HCO3會分解)和CO2的通入速度(以出現能數得清的連續氣泡為宜)。反應結束后,把錐形瓶浸入冷水中,使較多的晶體析出,過濾、洗滌。

請回答下列問題:
①為控制反應溫度在30~35 ℃,應采用的操作方法是________________________。
②裝置B中的試劑是__________________,它的作用是__________________________。
③檢驗步驟2中所得晶體是NaHCO3而不是NaCl的實驗方法和現象是
________________________________________________________________________
________________________________________________________________________。
④設計一個簡單的實驗方案證明Na2CO3溶液呈堿性是由CO32-引起的
________________________________________________________________________
________________________________________________________________________。
(1)CO2在水(或飽和食鹽水)中溶解度小,不利于NaHCO3的生成
(2)①水浴控溫
②飽和NaHCO3溶液 除去CO2氣體中的HCl氣體
③取少量晶體于試管中,向其中加入適量鹽酸,反應劇烈冒出大量氣泡,最后剩余物全部溶解,說明得到的晶體為NaHCO3(如果加入鹽酸后晶體全部溶解而無氣泡產生,則得到的晶體可能是食鹽)
④先向少量Na2CO3溶液中滴入酚酞溶液,溶液顯紅色;再向該溶液中滴入過量CaCl2溶液,產生白色沉淀,且溶液的紅色退去
【解析】
試題分析:本題的命題意圖是考查分析實驗方案的能力。知識依托是“侯氏制堿法”的反應原理(已提示)。其實驗過程大致為:先用石灰石和稀鹽酸制取CO2(A裝置),然后用飽和NaHCO3溶液除去CO2氣體中混有的HCl氣體(B裝置),再將純凈的CO2氣體通入溶有氨的飽和食鹽水中,即得NaHCO3(C裝置)。用加稀鹽酸或加稀H2SO4的方法可以區分NaHCO3和NaCl,前者遇酸逸出氣體,而后者不能。向少量Na2CO3溶液中滴入酚酞溶液,溶液顯紅色,可說明溶液呈堿性,再向該溶液中滴入過量CaCl2溶液,使CO32-被Ca2+完全沉淀掉,溶液的紅色退去,可說明Na2CO3溶液的堿性是由CO32-引起的。
考點:考查碳酸鈉制備原理的有關判斷以及化學實驗基本操作
點評:該題是高考中的常見考點和題型,屬于中等難度試題的考查,試題綜合性強,在注重對學生基礎知識鞏固和訓練的同時,側重對學生能力的培養和解題方法的指導與訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力,有利于培養學生的邏輯推理能力和規范嚴謹的實驗設計能力。該題的關鍵是明確侯氏制堿法的原理,然后結合題意靈活運用即可。該類試題主要是常見儀器的選用、實驗基本操作為中心,通過是什么、為什么和怎樣做重點考查實驗基本操作的規范性和準確性及靈活運用知識解決實際問題的能力


科目:高中化學 來源: 題型:閱讀理解
| ||

查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
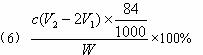
四種鹽在不同溫度下的溶解度(g/100 g水)表

(說明:①>35 ℃ NH4HCO3會有分解)
請回答以下問題:
(1)裝置的連接順序應是_________________________(填字母)。
(2)A裝置中盛放的試劑是_________,其作用是____________________________________。
(3)在實驗過程中,需要控制D溫度在30—35 ℃,原因是___________________________。為了便于控制此溫度范圍,采取的加熱方法為____________________________________。
(4)反應結束后,將錐形瓶浸在冷水中,析出NaHCO3晶體的原因是____________。用蒸餾水洗滌NaHCO3晶體的目的是除去___________________________雜質(以化學式表示)。
(5)將錐形瓶中的產物過濾后,所得的母液中含有______________(以化學式表示),可加入氯化氫,并進行_________操作,使NaCl溶液循環使用,同時可回收NH4Cl。
(6)測試純堿產品中NaHCO3含量的方法是:準確稱取純堿樣品W g,放入錐形瓶中加蒸餾水溶解,加1—2滴酚酞指示劑,用物質的量濃度為c( mol·L-1)的HCl溶液滴定至溶液由紅色到無色(指示![]() +H+====
+H+====![]() 反應的終點),所用HCl溶液體積為V1 mL,再加1—2滴甲基橙指示劑,繼續用HCl溶液滴定至溶液由黃變橙,所用HCl溶液總體積為V2 mL。寫出純堿樣品中NaHCO3質量分數的計算式:w(NaHCO3)=_________________。
反應的終點),所用HCl溶液體積為V1 mL,再加1—2滴甲基橙指示劑,繼續用HCl溶液滴定至溶液由黃變橙,所用HCl溶液總體積為V2 mL。寫出純堿樣品中NaHCO3質量分數的計算式:w(NaHCO3)=_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
第一步:連接好裝置,檢驗氣密性,在儀器內裝入藥品。
第二步:先讓一裝置發生反應,直到產生的氣體不能再在C中溶解時,再通入另一裝置中產生的氣體,片刻后,C中出現固體。繼續向C中通入兩種氣體,直到不再有固體產生。
第三步:過濾C中所得的混合物,得到NaHCO3固體。
第四步:向濾液中加入適量的NaCl粉末,又有晶體析出,……
請回答下列問題:

(1)裝置的連接順序是:(a)接(_________)![]() (_________)接(_________);
(_________)接(_________);
(b)接(_________)。
(2)A中常選用的固體反應物為_________;D中應選用的液體為_________。
(3)B裝置中分液漏斗內所加試劑為_________;第二步中必須先讓_________裝置發生反應。c中用球形干燥管而不用直導管,其作用是_________。
(4)第四步分離所得的晶體中含有多種成分,試證明其中含有NH4CI,簡要寫出操作過程和現象____________________。
查看答案和解析>>
科目:高中化學 來源:2012屆高三上學期單元測試(6)化學試卷(新人教版) 題型:實驗題
(10分)我國化工專家侯德榜的“侯氏制堿法”曾為世界制堿工業做出了突出貢獻。他利用NaHCO3、NaCl、N H4C1等物質
H4C1等物質 溶解度的差異,以食
溶解度的差異,以食 鹽、氨氣、二氧化碳等為原料制得NaHCO3,進而生產出純堿。以下A、B、C、D四個裝置可組裝成實驗室模擬 “侯氏制堿法”制取NaHCO3的實驗裝置。裝置中分別盛有以下試劑:B:稀硫酸;C:鹽酸、碳
鹽、氨氣、二氧化碳等為原料制得NaHCO3,進而生產出純堿。以下A、B、C、D四個裝置可組裝成實驗室模擬 “侯氏制堿法”制取NaHCO3的實驗裝置。裝置中分別盛有以下試劑:B:稀硫酸;C:鹽酸、碳 酸鈣;D:含氨的飽和食鹽水、水
酸鈣;D:含氨的飽和食鹽水、水
四種鹽在不同溫度下的溶解度(g/100g水)表
| | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36_3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | —① | — | — | — |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | |
| NH4Cl | 29.4 | 33.3 | 37.2[ 來源:Z|xx|k.Com] 來源:Z|xx|k.Com] | 41.4 | 45.8[來源:Z*xx*k.Com] | 50.4 | 55.3 | 77.3 |
 5)將錐形瓶中的產物過濾后,所得的母液中含有 (以化學式表示),加入氯化氫,并進行 操作,使NaCl溶液循環使用,同時可回收NH4C1。
5)將錐形瓶中的產物過濾后,所得的母液中含有 (以化學式表示),加入氯化氫,并進行 操作,使NaCl溶液循環使用,同時可回收NH4C1。查看答案和解析>>
科目:高中化學 來源:2012屆四川省資中縣高三零模考試理綜試題(化學部分) 題型:實驗題
(14分)我國化工專家侯德榜的“侯氏制堿法”曾為世界制堿工業做出了突出貢獻。他利用NaHCO3、NaCl、NH4Cl等物質溶解度的差異,以食鹽、氨氣、二氧化碳等為原料先制得NaHCO3,進而生產出純堿。下面是在實驗室中模擬“侯氏制堿法”制取NaHCO3的實驗步驟:
第一步:連接好裝置,檢驗氣密性,在儀器內裝入藥品。
第二步:先讓一裝置發生反應,直到產生的氣體不能再在C中溶解時,再通入另一裝置中產生的氣體,片刻后,C中出現固體。繼續向C中通入兩種氣體,直到不再有固體產生。
第三步:過濾C中所得的混合物,得到NaHCO3固體。
第四步:向濾液中加入適量的NaCl粉末,有NH4Cl晶體析出。……
請回答下列問題:
(1)裝置的連接順序是:(a)接( ) ( )接( );(b)接( )
(2)A中常選用的固體反應物為____________;D中應選用的液體為___________ (填化學式)
(3)第二步驟中必須先讓________裝置先發生反應。
(4)C中用球形干燥管而不用直導管,其作用是____________________________,C中廣口瓶內產生固體的總化學方程式為 。
(5)在第四步中分離NH4Cl晶體的操作是________________(填操作名稱);其所得的NH4Cl晶體中常含有少量的NaCl和NaHCO3約占5%—8%),請設計一個簡單的實驗證明所得固體的成分中含有Na+。簡要寫出操作和現象 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com