
【題目】[化學一選修3:物質結構與性質](15 分)
鈾是原子反應堆的原料,常見鈾的化合物有UF4、UO2及(NH4)4[UO2(CO3)3等。
回答下列問題:
(1) UF4用Mg或Ca 還原可得金屬鈾。基態鈣原子的核外電子排布式為__________________;熔點:MgO(2852℃)高于CaO(2614℃),原因是_______________________________;金屬鈾的一種堆積方式為體心立方堆積,該堆積方式的空間利用率為_______________________________。
(2)已知:2UO2+5NH4HF2 ![]() 2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填選項字母)。
2UF4·NH4F+3NH3↑+ 4H2O↑,NH4HF2中含有的作用力是________(填選項字母)。
a.氫鍵 b.配位鍵 c.共價鍵 d.離子鍵 e.金屬鍵
(3)已知:3[(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
3UO2+10NH3 ↑+9CO2 ↑+N2 ↑+9H2O↑
①NH4+的空間構型為_____________________,與NH4+互為等電子體的分子或離子有_____(任寫兩種)。
②CO32-中碳原子的雜化軌道類型為___________________________。
③分解產物中屬于非極性分子的是____________________(填選項字母)。
a.NH3 b. CO2 C.N2 d. H2O
(4)UO2的晶胞結構及晶胞參數如圖所示:
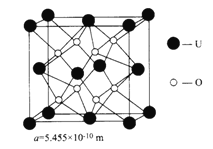
①晶胞中U 的配位數為__________________________。
②UO2晶體的密度為_____________g·cm-3(列出計算式即可。設NA表示阿伏加德羅常數的值)。
【答案】 1s22s22p63s23p64s2(或[Ar]4s2) CaO和MgO均為離子晶體,MgO的晶格能大于CaO 68% abcd 正四面體 CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4 sp2 bc 8 (4×270)/[NA×(5.455×10-8)3]
【解析】(1) CaO和MgO都是由活潑金屬與活潑非金屬組成的化合物,屬于離子化合物,離子晶體的熔點由其晶格能大小決定,MgO的晶格能大于CaO,故熔點:MgO(2852℃)高于CaO(2614℃);鈣為20號元素,基態鈣原子的核外電子排布式為1s22s22p63s23p64s2或[Ar]4s2;金屬鈾的一種堆積方式為體心立方堆積,該堆積方式的空間利用率為68%;(2)NH4HF2中NH4+與HF2-間為離子鍵,H-N為極性共價鍵、配位鍵;HF2-的結構式為[F-H![]() F]-含有氫鍵結構。答案選abcd;(3)①NH4+中的N為sp3雜化,四個N—H鍵的鍵能、鍵長及鍵角均相同,空間構型為正四面體;等電子體是指價電子數和原子數(氫等輕原子不計在內)相同的分子、離子或原子團,與NH4+互為等電子體的分子或離子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4;②CO32-價層電子對數目為
F]-含有氫鍵結構。答案選abcd;(3)①NH4+中的N為sp3雜化,四個N—H鍵的鍵能、鍵長及鍵角均相同,空間構型為正四面體;等電子體是指價電子數和原子數(氫等輕原子不計在內)相同的分子、離子或原子團,與NH4+互為等電子體的分子或離子有CH4、BH4-、BeH42-、AlH4-、SiH4、GeH4;②CO32-價層電子對數目為![]() =3,碳原子的雜化軌道類型為sp2雜化;③a、NH3中含有極性鍵,空間結構為三角錐形,正負電荷的中心不重合,屬于極性分子,故a錯誤;b、CO2中含有極性鍵,為直線形分子,結構對稱,分子中正負電荷重心重疊,為非極性分子,故b正確;c、H2O中含有極性鍵,為V形分子,但結構不對稱,屬于極性分子,故c錯誤;d、H2O中含有極性鍵,為V形分子,但結構不對稱,屬于極性分子,故d錯誤;答案選bc;(4)①由晶胞的面心觀察,可知U的配位數為8,O的配位數為4;②晶胞中U為
=3,碳原子的雜化軌道類型為sp2雜化;③a、NH3中含有極性鍵,空間結構為三角錐形,正負電荷的中心不重合,屬于極性分子,故a錯誤;b、CO2中含有極性鍵,為直線形分子,結構對稱,分子中正負電荷重心重疊,為非極性分子,故b正確;c、H2O中含有極性鍵,為V形分子,但結構不對稱,屬于極性分子,故c錯誤;d、H2O中含有極性鍵,為V形分子,但結構不對稱,屬于極性分子,故d錯誤;答案選bc;(4)①由晶胞的面心觀察,可知U的配位數為8,O的配位數為4;②晶胞中U為![]() ,O為8,立方體體積為
,O為8,立方體體積為![]() ,
,  。
。


 快樂小博士鞏固與提高系列答案
快樂小博士鞏固與提高系列答案科目:高中化學 來源: 題型:
【題目】碳的氧化物對環境的影響較大,CO是燃煤工業生產中的大氣污染物,CO2則促進了地球的溫室效應。給地球生命帶來了極大的威脅。
(1)已知:①甲醇的燃燒熱△H=-726.4kJ·mol-1
②H2(g)+ ![]() O2(g)=H2O(l) △H=-285.8kJ·mol-1。
O2(g)=H2O(l) △H=-285.8kJ·mol-1。
則二氧化碳和氫氣合成液態甲醇,生成液態水的熱化學方程式為_____________________________。
(2)二氧化碳合成CH3OH 的熱化學方程式為CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H1,過程中會產生副反應:CO2(g)+H2(g)
CH3OH(g)+H2O(g)△H1,過程中會產生副反應:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H2。圖1是合成甲醇反應中溫度對CH3OH、CO的產率影響曲線圖,△H2________0(填“>”或“<”)。增大反應體系的壓強,合成甲醇的反應速率___________(填“增大”“減小”或“ 不變”),副反應的化學平衡________(填“向正反應方向”“向逆反應方向”或“不”)移動。
CO(g)+H2O(g)△H2。圖1是合成甲醇反應中溫度對CH3OH、CO的產率影響曲線圖,△H2________0(填“>”或“<”)。增大反應體系的壓強,合成甲醇的反應速率___________(填“增大”“減小”或“ 不變”),副反應的化學平衡________(填“向正反應方向”“向逆反應方向”或“不”)移動。
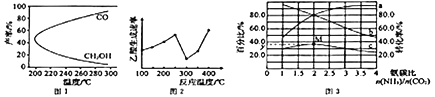
(3)以某些過渡金屬氧化物作催化劑,二氧化碳與甲烷可轉化為乙酸:CO2(g) +CH4(g)![]() CH3COOH(g) △H=+36.0kJ·mol-1。不同溫度下,乙酸的生成速率變化曲線如圖2。結合反應速率,使用催化劑的最佳溫度是________℃,欲提高CH4的轉化率,請提供一種可行的措施:____________________________。
CH3COOH(g) △H=+36.0kJ·mol-1。不同溫度下,乙酸的生成速率變化曲線如圖2。結合反應速率,使用催化劑的最佳溫度是________℃,欲提高CH4的轉化率,請提供一種可行的措施:____________________________。
(4)一定條件下,CO2 與NH3 可合成尿素[CO(NH2)2]:CO2(g)+2NH3(g)![]() CO(NH2)2(g)+H2O(g)△H。某溫度下。在容積為1L的恒容密閉容器中,加入一定氨碳比
CO(NH2)2(g)+H2O(g)△H。某溫度下。在容積為1L的恒容密閉容器中,加入一定氨碳比![]() 的3molCO2 和NH3的混合氣體。圖3是有關量的變化曲線,其中表示NH3轉化率的是曲線________(填“a”或“b”),曲線c 表示尿素在平衡體系中的體積分數變化曲線,則M點的平衡常數K=________,y=________。
的3molCO2 和NH3的混合氣體。圖3是有關量的變化曲線,其中表示NH3轉化率的是曲線________(填“a”或“b”),曲線c 表示尿素在平衡體系中的體積分數變化曲線,則M點的平衡常數K=________,y=________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應2SO2(g)+O2(g)![]() 2SO3(g)從正方向開始,并達到了平衡,此時SO2和O2的物質的量之比為2∶1;若采取某種措施,導致SO2和O2又消耗了一些,并再次達到平衡,下列說法正確的是
2SO3(g)從正方向開始,并達到了平衡,此時SO2和O2的物質的量之比為2∶1;若采取某種措施,導致SO2和O2又消耗了一些,并再次達到平衡,下列說法正確的是
A. 新平衡體系中,SO2和O2物質的量之比仍為2∶1
B. 平衡向正反應方向移動,原因是正反應速率增大,逆反應速率減小
C. 新平衡體系與舊平衡體系比較,SO3的濃度肯定增大
D. 若采取的措施是縮小容器的容積,則新舊平衡中SO2和O2的轉化率之比都是1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將8gNaOH固體溶于水配成500mL溶液,此溶液中NaOH的物質的量濃度為__mol/L;若取出10mL該溶液,則Na+的物質的量濃度為__mol/L,其中含NaOH的質量為____g;將這500 mL溶液濃縮成100mL后,NaOH的物質的量濃度為__mol/L,若所得溶液的密度為dg/mL,則該濃溶液溶質的質量分數為____________(蒸發過程中沒有溶質析出)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據下列實驗事實,不能得到相應結論的是
選項 | 實驗操作和現象 | 結論 |
A | 向醋酸溶液中滴加少量Na2SiO3溶液,觀察到白色沉淀 | 醋酸的酸性強于H2SiO3 |
B | 向均盛有2mL5% H2O2溶液的兩支試管中分別滴入0.2mol/LFeCl3和0.3mol/LCuCl2溶液各1mL,前者生成氣泡的速率更快 | 催化效果: Fe3+> Cu2+ |
C | 向一定濃度的醋酸溶液中加入鎂條,產生氣泡的速率會先加快再減慢 | 反應產生氣泡速度變化,是因為醋酸電離平衡先正向移動,再逆向移動 |
D | 常溫下分別測等濃度的醋酸和氨水pH,二者的pH 分別為2和12 | 常溫下,醋酸和氨水的電離平衡常數相等 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】堿性鋅錳干電池在放電時,電池的總反應方程式可以表示為: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。電池放電時,負極上發生反應的物質是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
試題分析:根據總反應方程式可知Zn在反應中失去電子,發生氧化反應,所以作原電池的負極,MnO2得到電子,發生還原反應,作原電池的正極。因此答案是選項A。
考點:考查根據原電池反應原理確定電池的電極材料的知識
【題型】單選題
【結束】
17
【題目】在恒容隔熱容器中,下列說法可以證明可逆反應N2+3H2![]() 2NH3已達到平衡狀態的是( )
2NH3已達到平衡狀態的是( )
①1mol N≡N鍵斷裂的同時,有6mol N-H鍵斷裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他條件不變時,體系氣體密度不再改變
④NH3、N2、H2的體積分數都不再改變
⑤體系溫度不再改變
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:N2(g)+3H2(g)![]() 2NH3(g) H=-92.2 kJ·mol-1 ,據此回答以下問題:
2NH3(g) H=-92.2 kJ·mol-1 ,據此回答以下問題:
(1)①某溫度下,若把 10 mol N2 與 30 mol H2置于體積為 10 L 的密閉容器內,反應達到平衡狀態時,測得混合氣體中氨的體積分數為 20%,則該溫度下反應的K=_______ (可用分數表示)。
②對于合成氨反應而言,下列有關圖像一定正確的是______(選填序號)。
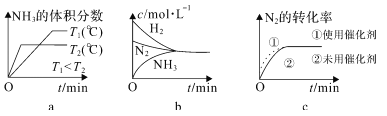
③在堿性溶液中通過電解法可以實現由 N2 制取 NH3:2N2+6H2O![]() 4NH3+3O2,陰極的電極反應式是_______________。
4NH3+3O2,陰極的電極反應式是_______________。
(2)室溫下,若將 0.1 mol·L-1 鹽酸滴入 20 mL 0.1 mol·L-1 氨水中,溶液 pH 隨加入鹽酸體積的變化曲線如下圖所示。
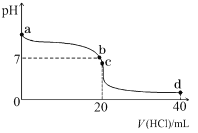
①NH3·H2O 的電離方程式是_______________。
②b 點所示溶液中的溶質是_______________。
③c 點所示溶液中,離子濃度從大到小的關系為_______________。
④常溫下,若將 amol/LNH3·H2O 與等體積的 bmol/L 的鹽酸混合,充分反應后溶液呈中性(不考慮氨水和鹽酸的揮發),則該溫度下 NH3·H2O 的電離常數Ka=___________(用含 a 和 b 的代數式表示)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com