
【題目】![]() 時,下列關系式正確的是
時,下列關系式正確的是
A.![]() 的
的![]() 溶液與
溶液與![]() 的
的![]() 溶液等體積混合:
溶液等體積混合:![]()
B.鹽酸與![]() 的混合溶液
的混合溶液![]() ,稀釋10倍后:
,稀釋10倍后:![]()
C.pH相同的①![]() ;②
;②![]() ;③
;③![]() 三種溶液稀釋后
三種溶液稀釋后![]() :②>①>③
:②>①>③
D.同濃度的①NH4HSO4 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2 ④NH4HCO3 ⑤(NH4)2CO3溶液中![]() 的濃度由大到小的順序為③>②>⑤>④>①
的濃度由大到小的順序為③>②>⑤>④>①
【答案】B
【解析】
A.![]() 時,
時,![]() 的硫酸中
的硫酸中![]() =10-3mol/L,
=10-3mol/L,![]() 的氨水中c(OH-)=10-3mol/L,由于一水合氨存在電離平衡,所以氨水的濃度大于硫酸的濃度;二者等體積混合氨水有大量剩余,一水合氨電離程度大于銨根離子水解程度,導致溶液呈堿性,則
的氨水中c(OH-)=10-3mol/L,由于一水合氨存在電離平衡,所以氨水的濃度大于硫酸的濃度;二者等體積混合氨水有大量剩余,一水合氨電離程度大于銨根離子水解程度,導致溶液呈堿性,則![]() ,根據電荷守恒得
,根據電荷守恒得![]() ,故A錯誤;
,故A錯誤;
B.![]() 的鹽酸稀釋10倍后
的鹽酸稀釋10倍后![]() ,加水稀釋促進FeCl2水解,導致稀釋10倍后溶液中
,加水稀釋促進FeCl2水解,導致稀釋10倍后溶液中![]() ,則溶液的
,則溶液的![]() ,故B正確;
,故B正確;
C.同pH的![]() 與
與![]() 溶液中,都是強酸弱堿鹽,根據溶液呈電中性可判斷二者
溶液中,都是強酸弱堿鹽,根據溶液呈電中性可判斷二者![]() 濃度相等,由于
濃度相等,由于![]() 電離時產生
電離時產生![]() 而抑制
而抑制![]() 水解,因此
水解,因此![]() 中
中![]() 的濃度小于
的濃度小于![]() ,三種溶液的
,三種溶液的![]() :
:![]() ,故C錯誤;
,故C錯誤;
D.![]() 中
中![]() 抑制
抑制![]() 水解,
水解,![]() 中
中![]() 抑制
抑制![]() 水解,
水解,![]() 中
中![]() 促進水解
促進水解![]() ,
,![]() 中
中![]() 促進
促進![]() 水解,如果相同化學式中
水解,如果相同化學式中![]() 水解程度越大溶液中
水解程度越大溶液中![]() 越小,同濃度的下列溶液中
越小,同濃度的下列溶液中![]() 的濃度由大到小的順序為
的濃度由大到小的順序為![]() ,故D錯誤;
,故D錯誤;
故答案為B。


科目:高中化學 來源: 題型:
【題目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列說法正確的是
A. ①和②產物的陰陽離子個數比不相等
B. ①和②生成等物質的量的產物,轉移電子數不同
C. 常溫下Na與足量O2反應生成Na2O,隨溫度升高生成Na2O的速率逐漸加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用純凈的CaCO3與稀HCl反應制CO2,實驗過程記錄如右圖所示。根據分析、判斷,正確的是( )
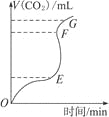
A.OE段表示的反應速率最快
B.EF段表示的反應速率最快,收集的CO2最多
C.FG段收集的CO2最多
D.OG段表示隨著時間的推移,反應速率逐漸增快
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1,2-二溴乙烷可作抗爆劑的添加劑。如圖為實驗室制備1,2-二溴乙烷的裝罝圖,圖中分液漏斗和燒瓶a中分別裝有濃H2SO4和無水乙醇,d裝罝試管中裝有液溴。
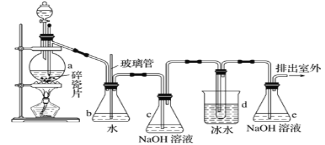
相關數據列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
狀態 | 無色液體 | 無色液體 | 無色液體 | 紅棕色液體 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸點/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔點/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 難溶 | 微溶 | 可溶 |
(1)裝置a中發生主要反應的方程式為:___。為防止副反應發生,實驗中的具體操作為:___。
(2)安全瓶b在實驗中有多重作用。其一可以檢查實驗進行中d裝罝中導管是否發生堵塞,如果實驗時d裝罝中導管堵塞,你認為可能的原因:___;安全瓶b還可以起到的作用是:___。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是___。
(4)某學生在做此實驗時,使用一定量的液溴,當溴全部褪色時,所消耗乙醇和濃硫酸混合液的量,比理論值超過許多,如果裝罝的氣密性沒有問題,試分析可能的原因:___、___(寫出兩條即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某芳香族化合物A,與碳酸鈉溶液反應生成CO2,遇FeCl3溶液顯色,A分子結構中不含甲基,苯環上的一氯代物只有兩種, A和其他有機物存在如下圖所示的轉化關系:
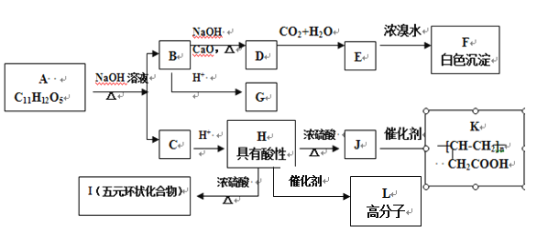
已知: ![]() +NaOH
+NaOH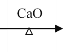 R—H + Na2CO3
R—H + Na2CO3
試回答下列問題:
(1)D化學式___。
(2)H→L反應類型為___,J所含官能團的名稱為___。
(3)寫出H→I反應的化學方程式___。
(4)A的結構簡式___。
(5)用系統命名法命名F___,F同分異構體中含有苯環且官能團相同的物質共有___種(不包括F),其中核磁共振氫譜有兩個峰,且峰面積比為1︰2的是___(寫結構簡式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定體積pH=2的NaHSO4溶液中,逐滴加入一定物質的量濃度的Ba(OH)2溶液,當溶液中的硫酸根恰好完全沉淀時,溶液的pH=11,若反應后溶液的體積等于反應的兩溶液的體積之和,則NaHSO4溶液與Ba(OH)2溶液的體積比為
A.1:9B.1:1C.1:2D.1:4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、Q、R是6種短周期元素,其原子半徑及主要化合價如下:
元素代號 | X | Y | Z | M | Q | R |
原子半徑/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
主要化合價 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
(1)Z在元素中期表中的位置是______________________________。
(2)X、Y、Q各自形成簡單離子,其中離子半徑最大的是__________(填離子符號)。
(3)周期表中有些處于對角線(左上→右下)位置的元素,它們的單質及其化合物的性質相似,則M的氧化物與強堿溶液反應的離子方程式______________________________。
(4)Q和R按原子個數比1:1組成的化合物甲是一種“綠色”氧化劑。
①甲中所含共價鍵類型是____________________。
②空氣陰極法電解制備甲的裝置如圖所示。在堿性溶液中,利用空氣中的氧氣還原得到甲和稀堿的溶液。圖中a是__________極,陰極的電極反應式是____________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸銅是一種應用極其廣泛的化工原料;以下是某工廠用含鐵廢銅為原料生產膽礬(CuSO45H2O)和副產物石膏(CaSO42H2O)的生產流程示意圖:
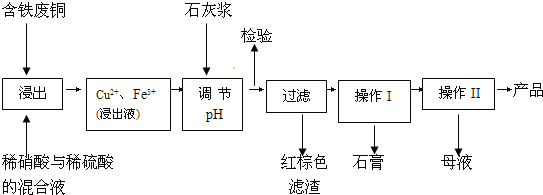
膽礬和石膏在不同溫度下的溶解度(g/100g水)見表。
溫度(℃) | 20 | 40 | 60 | 80 | 100 |
石膏 | 0.32 | 0.26 | 0.15 | 0.11 | 0.07 |
膽礬 | 32 | 44.6 | 61.8 | 83.8 | 114 |
請回答下列問題:
(1)紅棕色濾渣的主要成分是___;
(2)寫出浸出過程中生成硫酸銅的離子方程式___;
(3)操作I包括蒸發濃縮、__等操作,溫度應該控制在__℃左右;
(4)從溶液中分離出硫酸銅晶體的操作Ⅱ應為__、___、洗滌、干燥;晶體用無水乙醇作洗滌液而不用蒸餾水的原因是__;干燥時采用晾干,不用加熱烘干的原因是___。
(5)取樣檢驗是為了確認Fe3+是否除凈。有同學設計了以下兩種方案,在實驗室分別對所取樣品按下列方案進行操作:
方案一:取樣于試管→滴加KSCN溶液; 方案二:紙層析→噴KSCN溶液;
①你認為上述兩種方案設計更合理的是__;
②指出你認為不合理方案存在的問題是__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:有機物 A 的產量可以用來衡量一個國家的石油化工發展水平,B 和 D 是生活中兩種常見的有機物。現以 A 為主要原料合成乙酸乙酯,其合成路線如圖 1 所示。

(1)B 分子中官能團的名稱是____,反應①的反應類型是____反應;
(2)反應②的化學方程式是____,反應④的化學方程式是____;
(3)E 是常見的高分子材料,E 的結構簡式是____;
(4)某同學用如圖 2 所示的實驗裝置制取少量乙酸乙酯。實驗結束后,試管甲中上層為透明的、不溶于水的油狀液體。實驗時,甲中飽和碳酸鈉溶液的作用是(填字母)____。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.加速酯的生成,提高其產率
D.乙酸乙酯在飽和碳酸鈉溶液中的溶解度比在水中更小,有利于分層析出
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com