
科目:高中化學 來源:2012屆江蘇省啟東中學高三上學期期中考試化學試卷 題型:實驗題
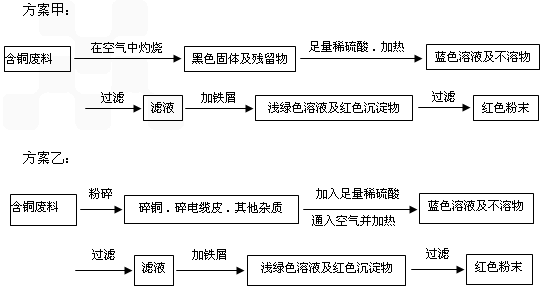
(12分) 從回收的含銅電纜廢料中提取銅時,假若設計如下兩種方案,回答有關問題。
方案甲:
方案乙:
(1)兩個方案中,符合當前生產中綠色化學理念的是方案 ,理由是 。
(2)方案乙中銅溶解生成藍色溶液時發生反應的離子方程式為________________________,
若不考慮綠色化學要求,溶解銅生成硫酸銅時,還可將適量硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使銅溶解完全,則理論上硫酸和硝酸的物質的量之比最佳為: ︰ 。
(3)為了提高原料的利用率,最后一步所得淺綠色濾液通過蒸發濃縮、冷卻結晶、過濾、洗滌、自然干燥可得到一種結晶水合物的晶體。獲得晶體后對其進行檢測:
①先取a g的晶體進行脫水實驗,獲得無水固體為(a—1.26)g
②將無水固體溶于足量的水配成溶液后滴加1.00mol/L的氯化鋇溶液,當滴加10.00mL溶液時,沉淀恰好完全。
通過計算測知該晶體的化學式是 。
(4)氯化亞銅(CuCl)是重要的化工原料。國家標準規定合格的CuCl產品的主要質量指標為CuCl的質量分數大于96.5% 。工業上用硫酸銅等原料常通過下列反應制備CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 =" 2" CuCl ↓+ 3 Na2SO4 + CO2↑
測定CuCl質量分數時先準確稱取所制備的0.2500g CuCl樣品置于一定量的0.5mol·L-1 FeCl3溶液中,待樣品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到終點,消耗24.60mL Ce(SO4)2溶液。有關反應的離子方程式為:
Fe 3++CuCl=Fe 2++Cu2++Cl-,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
通過計算說明上述樣品中CuCl的質量分數是否符合標準。
查看答案和解析>>
科目:高中化學 來源:2014屆江蘇省高三上學期第一次月考化學試卷(解析版) 題型:填空題
從回收的含銅電纜廢料中提取銅時,假若設計如下兩種方案,回答有關問題。
方案甲:
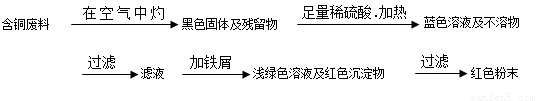
方案乙:
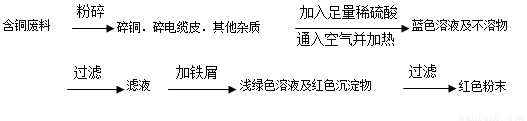
(1)兩個方案中,符合當前生產中綠色化學理念的是方案 ,理由是 方案第一步“灼燒”會產生污染空氣的氣體、粉塵、煙霧。
(2)方案乙中銅溶解生成藍色溶液時發生反應的離子方程式為________________ _ ______。
(3)為了提高原料的利用率,最后一步所得淺綠色濾液通過蒸發濃縮、冷卻結晶、過濾、洗滌、自然干燥可得到一種結晶水合物的晶體。獲得晶體后對其進行檢測:
①先取a g的晶體進行脫水實驗,獲得無水固體為(a—1.26)g
②將無水固體溶于足量的水配成溶液后滴加1.00mol/L的氯化鋇溶液,當滴加10.00mL溶液時,沉淀恰好完全。通過計算測知該晶體的化學式是 。
(4)氯化亞銅(CuCl)是重要的化工原料。國家標準規定合格的CuCl產品的主要質量指標為CuCl的質量分數大于96.5% 。工業上用硫酸銅等原料常通過下列反應制備CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3=2 CuCl ↓+ 3 Na2SO4 + CO2↑
測定CuCl質量分數時先準確稱取所制備的0.2500g CuCl樣品置于一定量的0.5mol·L-1 FeCl3 溶液中,待樣品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到終點,消耗24.60mL Ce(SO4)2溶液。有關反應的離子方程式為:Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+ =Fe 3+ + Ce3+
計算上述樣品中CuCl的質量分數為 。
查看答案和解析>>
科目:高中化學 來源:2011-2012學年江蘇省高三上學期期中考試化學試卷 題型:實驗題
(12分) 從回收的含銅電纜廢料中提取銅時,假若設計如下兩種方案,回答有關問題。
方案甲:

方案乙:

(1)兩個方案中,符合當前生產中綠色化學理念的是方案 ,理由是 。
(2)方案乙中銅溶解生成藍色溶液時發生反應的離子方程式為________________________,
若不考慮綠色化學要求,溶解銅生成硫酸銅時,還可將適量硝酸分多次加入到銅粉與稀硫酸的混合物中,加熱使銅溶解完全,則理論上硫酸和硝酸的物質的量之比最佳為: ︰ 。
(3)為了提高原料的利用率,最后一步所得淺綠色濾液通過蒸發濃縮、冷卻結晶、過濾、洗滌、自然干燥可得到一種結晶水合物的晶體。獲得晶體后對其進行檢測:
①先取a g的晶體進行脫水實驗,獲得無水固體為(a—1.26)g
②將無水固體溶于足量的水配成溶液后滴加1.00mol/L的氯化鋇溶液,當滴加10.00mL溶液時,沉淀恰好完全。
通過計算測知該晶體的化學式是 。
(4)氯化亞銅(CuCl)是重要的化工原料。國家標準規定合格的CuCl產品的主要質量指標為CuCl的質量分數大于96.5% 。工業上用硫酸銅等原料常通過下列反應制備CuCl :
2CuSO4+ Na2SO3 + 2 NaCl + Na2CO3 = 2 CuCl ↓+ 3 Na2SO4 + CO2↑
測定CuCl質量分數時先準確稱取所制備的0.2500g CuCl樣品置于一定量的0.5mol·L-1 FeCl3 溶液中,待樣品完全溶解后,加水20mL,用0.1000mol·L-1 Ce(SO4)2溶液滴定到終點,消耗24.60mL Ce(SO4)2溶液。有關反應的離子方程式為:
Fe 3++CuCl=Fe 2++Cu2++Cl- ,Ce4+ + Fe 2+ = Fe 3+ + Ce3+
通過計算說明上述樣品中CuCl的質量分數是否符合標準。
查看答案和解析>>
科目:高中化學 來源:江蘇期中題 題型:填空題


查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com