
【題目】黃銅礦(CuFeS2)是煉銅的最主要礦物。火法冶煉黃銅礦的過程中,其中一步反應是: 2Cu2O+Cu2S![]() 6Cu+SO2。回答下列問題。
6Cu+SO2。回答下列問題。
(1)Cu+的價電子軌道表示式為________;Cu2O與Cu2S比較,熔點較高的是_____,原因是________。.
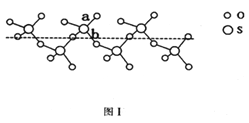
(2)SO2與SO3的健角相比,鍵角更大的是_____,將純液態SO3冷卻到289.8K時凝固得到一種螺旋狀單鏈結構的固體,其結構如下圖1,此固態SO3中S原子的雜化軌道類型是_________;該結構中S-O鍵長有兩類。一類鍵長約140pm,另一類鍵長月為160pm,較短的鍵為_______。(填圖中字母)
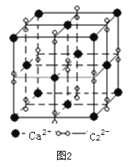
(3)離子化合物CaC2的一種晶體結構如圖2所示。該物質的電子式_____。從鈣離子看,屬于________堆積,其配位數是_________;一個晶胞含有的π鍵平均有________個。
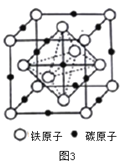
(4)奧氏體是碳溶解γ-Fe中形成的一種間隙固溶體,無磁性,其晶胞如圖3所示,則該物質的化學式為________,若晶體密度為dg/cm3,則晶胞中最近的兩個碳原子的距離為________pm (阿伏加德羅常數的值用NA表示,寫出計算式即可)。
【答案】 ![]() Cu2O 兩物質均為離子化合物,且帶電荷數相同,O2-半徑小于S2-,所以CuO的晶格能大,熔點更高 SO3 sp3 a
Cu2O 兩物質均為離子化合物,且帶電荷數相同,O2-半徑小于S2-,所以CuO的晶格能大,熔點更高 SO3 sp3 a ![]() 面心立方 8 略 FeC
面心立方 8 略 FeC ![]()
【解析】(1)Cu位于第四周期IB族,Cu+的價電子為第三層的d能級,根據泡利原理和洪特規則,Cu+價電子軌道式為![]() ;Cu2O和Cu2S都屬于離子晶體,晶格能越大,晶體熔沸點越高,晶格能與半徑、所帶電荷數有關,半徑越小、所帶電荷數越多,晶格能越大,Cu2O和Cu2S所帶電荷數相同,S2-的半徑大于O2-的半徑,因此Cu2S的沸點低于Cu2O;正確答案:
;Cu2O和Cu2S都屬于離子晶體,晶格能越大,晶體熔沸點越高,晶格能與半徑、所帶電荷數有關,半徑越小、所帶電荷數越多,晶格能越大,Cu2O和Cu2S所帶電荷數相同,S2-的半徑大于O2-的半徑,因此Cu2S的沸點低于Cu2O;正確答案:![]() ;Cu2O;物質均為離子化合物,且帶電荷數相同,O2-半徑小于S2-,所以CuO的晶格能大,熔點更高。
;Cu2O;物質均為離子化合物,且帶電荷數相同,O2-半徑小于S2-,所以CuO的晶格能大,熔點更高。
(2)SO2含有的孤電子對為(6-2×2)/2=1,SO3中含有孤電子對為(6-2×3)/2=0,孤電子對之間的斥力>孤電子對-成鍵電子對之間的斥力>成鍵電子對之間斥力,因此SO3鍵角大于SO2鍵角,根據圖1,S有4個σ鍵,無孤電子對,價層電子對數為4,雜化軌道數等于價層電子對數,即雜化類型為sp3;如圖所示,a含有雙鍵的成分,鍵能較大,鍵長較短,另一類為配位鍵,為單鍵,鍵能較小,鍵長較長,即較短的鍵為a; 正確答案:SO3 ; sp3 ; a。
(3)根據圖2,CaC2的電子式為:![]() ;根據晶胞的結構,Ca2+位于頂點和面心,因此屬于面心立方堆積;C22-位于棱上和體心,屬于晶胞的C22-的個數為12×1/4+1=4,根據CaC2的電子式,兩個碳原子之間有3對電子對,即1個C22-有2個π鍵,即1個晶胞中有2×4=8個π鍵;正確答案:
;根據晶胞的結構,Ca2+位于頂點和面心,因此屬于面心立方堆積;C22-位于棱上和體心,屬于晶胞的C22-的個數為12×1/4+1=4,根據CaC2的電子式,兩個碳原子之間有3對電子對,即1個C22-有2個π鍵,即1個晶胞中有2×4=8個π鍵;正確答案:![]() ;面心立方; 8。
;面心立方; 8。
(4)根據圖3,鐵原子位于頂點、面心,個數為8×1/8+6×1/2=4,碳原子位于棱上和體心,個數為12×1/4+1=4,因此化學式為FeC,晶胞的質量為4×68/NAg,根據密度的定義,得出晶胞的邊長為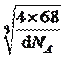 cm,根據晶胞的結構,兩個最近的碳原子的距離是面對角線的一半,則兩個最近的碳原子的距離是
cm,根據晶胞的結構,兩個最近的碳原子的距離是面對角線的一半,則兩個最近的碳原子的距離是![]() pm;正確答案:FeC ;
pm;正確答案:FeC ; ![]() 。
。


 走進文言文系列答案
走進文言文系列答案科目:高中化學 來源: 題型:
【題目】某單烯烴A(C8H16)可以發如下圖所示的轉化,回等下列問題:
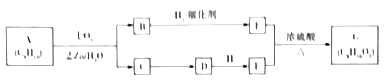
已知:a. 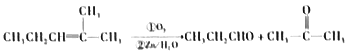
b.B的核磁共振氫譜圖中有2個峰,峰面積之比是2:3.
(1)B的分子式為______;E的名稱為______,1molE最多加與_____molNa2CO3反應.
(2)寫出C![]() D、E+F
D、E+F![]() G反應的化學方程式:___________。
G反應的化學方程式:___________。
(3)A能形成高分子(C8H16)n,平均1molA中含有的甲基數是____(用NA表示阿伏加德羅常數的值)。
(4)B不能發生銀鏡反應,其同分異構體X能發生銀鏡反應,X的結構有____種。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】元素W、X、Y、Z原子序數依次增加。p、q、r是由這些元素組成的二元化合物。m、n分別是元素Y、Z的單質,n通常為深紅棕色液體,0.01 mol/Lr溶液的pH為2,p被英國科學家法拉第稱為“氫的重碳化合物”,是一種常見的有機溶劑。s通常是難溶于水、比水重的油狀液體。上述物質的轉化關系如圖所示。下列說法錯誤的是( )
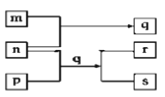
A. q的水溶液呈黃色 B. W的氧化物常溫常壓下為液態
C. p能使酸性高錳酸鉀溶液褪色 D. Z的氧化物的水化物可能為強酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖是某同學設計的放熱反應的觀察裝置。其實驗操作步驟如下:
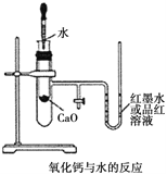
① 按圖所示將實驗裝置連接好;
② 在 U 形管內加入少量紅墨水(或品紅溶液),打開 T 形管活塞,使 U 形管內兩邊的液面處于同一水平 面,再關閉 T 形管活塞;
③ 在盛有 1.0g 氧化鈣的小試管里滴入 2mL 左右的蒸餾水,觀察現象。 試回答:
(1)實驗前必須進行的一步實驗操作是_____。
(2)實驗中觀察到的現象是_____。
(3)說明CaO、H2O的能量與Ca(OH)2的能量之間的關系:_________。
(4)若該實驗中 CaO 換成 NaCl,實驗還能否觀察到相同現象?_____(填“能” 或“否”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種價電子排布為2s22p5的元素,下列有關它的描述正確的有
A. 原子序數為8
B. 在同周期元素中非金屬性最強
C. 在同周期元素中,其原子半徑最大
D. 在同周期元素中,元素的第一電離能最大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】斷腸草(Gelsemium)為中國古代九大毒藥之一,據記載能“見血封喉”,現代查明它是葫蔓藤科植物葫發療,其中的毒素很多,下列是分離出來的四種毒素的結構式,下列推斷不正確的是

A. ①與②、③與④分別互為同分異構體
B. ①、③互為同系物
C. 等物質的量②、④分別在足量氧氣中完全燃燒,前者消耗氧氣比后者多
D. ①、②、③、④均能與氫氧化鈉溶液反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常見的一硝基甲苯有對硝基甲苯和鄰硝基甲苯兩種,均可用于合成各種染料。某探究小組利用下列反應和裝置制備一硝基甲苯。
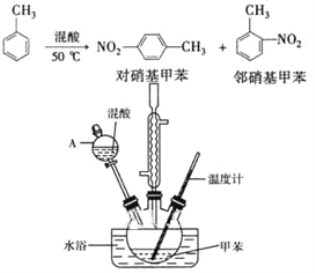
實驗中可能用到的數據:
密度/g·cm-3 | 沸點/℃ | 溶解性 | |
甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
對硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液態烴 |
鄰硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液態烴 |
實驗步驟:①按體積比1:3配制濃硫酸與濃硝酸混合物40 mL;
②在三頸瓶中加入15 mL(13g)甲苯,按圖所示裝好藥品和其他儀器;
③向三頸瓶中加入混酸,并不斷攪拌(磁力攪拌器已略去);
④控制溫度約為50℃,反應大約10 min,三頸瓶底有大量淡黃色油狀液體出現;
⑤分離出一硝基甲苯的總質量13.60 g。
請回答下列問題:
(1)配制混酸的方法是_______________________。反應中需不斷攪拌,目的是__________________________________________。
(2)儀器A的名稱是______,使用該儀器前必須進行的操作是____。
(3)若實驗后在三頸瓶中收集到的產物較少,可能的原因是_____。
(4)分離反應后產物的方案如下:

其中,操作1的名稱為______,操作2中需要使用下列儀器中的____(填序號)。
a.冷凝管 b.酒精燈 c.溫度計 d.分液漏斗 e.蒸發皿
(5)該實驗中一硝基甲苯的產率為______(保留4位有效數字)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A.非金屬元素的原子間不能形成離子化合物
B.Cl2、Br2、I2的分子間作用力依次增強,熔沸點依次升高
C.氯化氫氣體溶于水共價鍵被破壞
D.100℃時水由液態變為氣態,分子間作用力被破壞
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com