
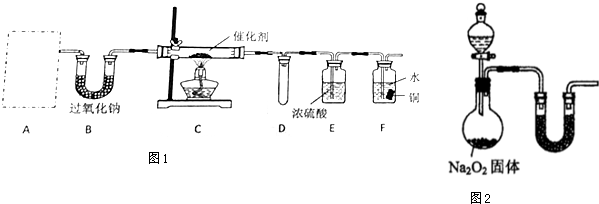
分析 4NH3+5O2$\frac{\underline{\;催化劑\;}}{△}$4NO+6H2O,進行氨的催化氧化實驗,需氨氣和氧氣,氨氣用碳酸氫銨制備,氧氣用二氧化碳與過氧化鈉反應制備,氨氣和氧氣催化氧化需用鉑粉作催化劑,一氧化氮二氧化氮都是空氣污染物,所以需進行尾氣吸收;
(1)①根據碳酸氫銨,受熱分解生成NH3、CO2和H2O選擇儀器;
②根據碳酸氫銨受熱分解的產物以及過氧化鈉的性質分析解答;
③NH3與O2在催化劑、加熱條件下發生反應生成一氧化氮和水;
④若A、B中藥品足量,則進入裝置F中的氣體為一氧化氮、氧氣的混合氣體,4NO+3O2+2H2O=4HNO3,硝酸能將銅氧化;
⑤該裝置存在的主要缺陷是,F中液體因為壓強變化的關系可能會倒吸,一氧化氮以及生成的二氧化氮均有毒,據此分析實驗裝置的優劣;
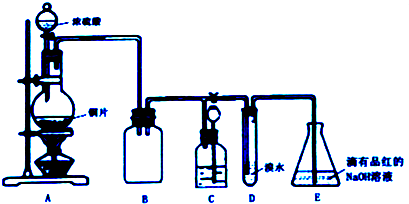
(2)①根據甲小組的裝置中A、B部分用途分析替代裝置,氨氣是堿性氣體,極易溶于水,做氨氣干燥劑的物質不能和氨氣反應,所以干燥氨氣的物質應為堿性或中性;
②過氧化鈉和氨水中水反應生成氫氧化鈉和氧氣,反應放熱,促進平衡逆向進行,NH3+H2O?NH3•H2O?NH4++OH-,利于放出氨氣.
解答 解:(1)①若A中使用的藥品是NH4HCO3固體,加熱NH4HCO3固體需要酒精燈,故答案為:b;
②裝置B中盛放過氧化鈉,碳酸氫銨受熱分解生成NH3、CO2和H2O,過氧化鈉和水反應2Na2O2+2H2O=4NaOH+O2↑,該反應能提供氧氣,二氧化碳與過氧化鈉,2Na2O2+2CO2═2Na2CO3+O2,該反應也能提供氧氣,所以裝置B的作用是與水和二氧化碳反應,產生C中所需的反應物氧氣,
故答案為:與水和二氧化碳反應,產生C中所需的反應物氧氣;
③NH3與過量O2在催化劑、加熱條件下發生反應生成一氧化氮和水,反應方程為4NH3+5O2$\frac{\underline{\;催化劑\;}}{△}$4NO+6H2O,
故答案為:4NH3+5O2$\frac{\underline{\;催化劑\;}}{△}$4NO+6H2O;
④若A、B中藥品足量,則進入裝置F中的氣體為一氧化氮、氧氣的混合氣體,4NO+3O2+2H2O=4HNO3,硝酸能將銅氧化,反應現象為:銅片逐漸溶解,表面有氣泡產生,溶液逐漸變藍,液面上方氣體逐漸變紅棕色,
故答案為:銅片逐漸溶解,表面有氣泡產生,溶液逐漸變藍,液面上方氣體逐漸變紅棕色;
⑤該裝置存在的主要缺陷是,F中液體因為壓強變化的關系可能會倒吸,一氧化氮以及生成的二氧化氮均有毒,應加一個尾氣吸收裝置,
故答案為:F中液體可能會倒吸,尾氣產生的NO2會污染環境;
(2)①A裝置提供二氧化碳、水蒸氣、氨氣,裝置B為干燥氨氣,所以當有過氧化鈉存在時需用濃氨水,省略了將二氧化碳、水蒸氣轉化成氧氣,氨氣為堿性氣體,干燥氨氣的物質應為堿性或中性需選用堿石灰(或氫氧化鈉、氧化鈣),
故答案為:濃氨水;堿石灰(或氫氧化鈉、氧化鈣);
②過氧化鈉和氨水中水反應生成氫氧化鈉和氧氣,反應放熱,氨水中存在NH3+H2O?NH3•H2O?NH4++OH-,堿石灰與水反應產生OH-并放出大量熱量,使平衡左移,利于NH3釋放,
故答案為:氨水中存在NH3+H2O?NH3•H2O?NH4++OH-,堿石灰與水反應產生OH-并放出大量熱量,使平衡左移,利于NH3釋放.
點評 本題主要考查了氨氣的催化氧化,解答須根據題目中提供的藥品和裝置結合該反應的原理和相關物質的性質,題目難度中等.


科目:高中化學 來源: 題型:實驗題
| 實驗序號 | 實驗操作 | 現象 | 反應的可能情況 |
| ① | 滴加少量淀粉碘化鉀溶液,振蕩 | III | |
| ② | 滴加少量棕紅色的KI3溶液,振蕩 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振蕩 | 溶液呈紫色 | |
| ④ | 加入幾小塊CaCO3固體 | 有氣泡產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
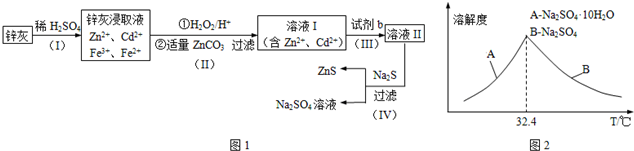
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ②④ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
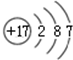 ②
②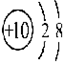 ③
③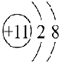 ④
④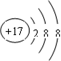
| A. | ①②兩種粒子所屬的元素在元素周期表的同一橫行 | |
| B. | ②③④對應的元素化學性質相似 | |
| C. | ①③對應的元素是同一周期元素 | |
| D. | ③④可形成X2Y型化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.01mol/L CH3COOH溶液 | B. | 0.01mol/L HNO3溶液 | ||
| C. | pH=2的H2SO4溶液 | D. | pH=2的CH3COOH溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com