
【題目】Ⅰ.現有硫酸和鹽酸的混合溶液20mL,在該溶液中滴入0.05mol/L的Ba(OH)2溶液時,生成BaSO4的質量和溶液的pH得到如圖所示的結果,求:

⑴最初混合液中硫酸的物質的量濃度____________________
鹽酸的物質的量濃度____________________
⑵在A點溶液的pH=____________________。
Ⅱ.Ba2+是一種重金屬離子,對生物體有害,環境監測小組欲利用Na2S2O3、KI、K2Cr2O7等試劑測定某工廠廢水中Ba2+的濃度。
(1)現需配制250mL0.100mol·L—1標準Na2S2O3溶液,所需要的玻璃儀器除量筒、250mL容量瓶、玻璃棒外,還需要_____________________。
(2)需準確稱取Na2S2O3固體的質量為________________g。
(3)另取廢水50.00mL,控制適當的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀經洗滌、過濾后,用適量的稀鹽酸溶解,此時CrO42-全部轉化為Cr2O72-;再加過量KI溶液反應,反應液中再滴加上述Na2S2O3溶液,反應完全時,消耗Na2S2O3溶液36.00mL。
已知有關的離子方程式為:
①Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O;
②I2+2S2O32- 2I-+S4O62-.試計算該工廠廢水中Ba2+的物質的量濃度c(Ba2+)=________________________。
Ⅲ.試回答下列問題:
(1)已知24 g A和40 g B恰好完全反應生成0.4 mol C和32 g D,則C的摩爾質量為_________________。
(2)把1 mol Na和1 mol Mg分別投入到等量且過量的鹽酸中,分別得到溶液a和b,則溶液a和b的質量關系為ma_____________mb。
(3)如圖為實驗室某濃鹽酸試劑瓶的標簽上的有關數據,試根據標簽上的有關數據回答下列問題:
鹽酸
分子式:HCl
相對分子質量:36.5
密度:1.19 g·cm-3
HCl的質量分數:36.5%
①該濃鹽酸中HCl的物質的量濃度為____________mol·L-1。
②標準狀況下,1.00 L水(密度為1.00 g·cm-3)吸收_____________L的HCl可制得上述濃鹽酸(保留整數)。
【答案】 0.05mol/L 0.2mol/L 1_ 燒杯、膠頭滴管 3.95 0.024mol·L-1 80 g/mol = 11.9 353
【解析】本題考查化學計算和一定物質的量濃度溶液的配、物質的量濃度的計算、摩爾質量的計算,I.(1)當加入20mLBa(OH)2溶液時,沉淀達到最大,即SO42-全部轉成沉淀,因此有n(H2SO4)=n(BaSO4)=n[(Ba(OH)2]=20×10-3×0.05mol=1×10-3mol,硫酸的濃度為c(H2SO4)=1×10-3/20×10-3mol·L-1=0.05mol·L-1;(2)當加入60mLBa(OH)2溶液,溶液的pH=7,說明H+和OH-恰好完全反應,即有60×10-3×0.05×2=20×10-3×0.05×2+n(HCl),解得n(HCl)=4×10-3mol,則c(HCl)=4×10-3/20×10-3mol·L-1=0.2mol·L-1;(2)A點沉淀達到最大,鹽酸未反應,因此溶液中c(H+)=20×10-3×0.2/40×10-3mol·L-1=0.1mol·L-1,根據pH=-lgc(H+)=1;II.(1)配制一定物質的量濃度的溶液需要的儀器是量筒、容量瓶、玻璃棒、燒杯、膠頭滴管,因此缺少的儀器是燒杯和膠頭滴管;(2)需要Na2S2O3的質量為250×10-3×0.1×158g=3.95g;(3)根據反應:Ba2++CrO42-=BaCrO4↓,加入適量鹽酸,發生反應:2CrO42-+2H+=Cr2O72-+H2O,再根據信息,建立關系式為2Ba2+~2CrO42-~Cr2O72-~3I2~6S2O32-,因此n(Ba2+)=36×10-3×0.1×2/6mol=1.2×10-3mol,則c(Ba2+)=1.2×10-3/50×10-3mol·L-1=0.024mol·L-1;III.(1)根據質量守恒,C的質量為(24+40-32)g=32g,根據M=m/n=32/0.4g·mol-1=80g·mol-1;(2)金屬鈉投入到鹽酸中,發生2Na+2HCl=2NaCl+H2↑,產生m(NaCl)=1×58.5g=58.5g,產生氫氣的質量為1×2/2g=1g,溶液的質量為 [(23+m(HCl)-1]g,金屬鎂加入到足量的鹽酸中,發生Mg+2HCl=MgCl2+H2↑,產生m(MgCl2)=1×95g=95g,溶液質量為 [24+n(HCl)-2]g,即ma=mb;(3)①根據c=1000ρw%/M=1000×1.19×36.5%/36.5mol·L-1=11.9mol·L-1;②溶液的質量為[1×1000×1+36.5n(HCl)]g,溶質的質量為36.5n(HCl)g,因此有36.5n(HCl)/ [1×1000×1+36.5n(HCl)]×100%=36.5%,解得n(HCl)=15.7mol,其體積為15.7×22.4L=353L。


 寒假天地重慶出版社系列答案
寒假天地重慶出版社系列答案科目:高中化學 來源: 題型:
【題目】下列有關有機物的說法正確的是( )
A. 氯乙烯、聚乙烯均可使酸性高錳鉀溶液褪色
B. C2H6O2與C3H6O2一定屬于同系物
C. 苯可以與溴水、高錳酸鉀溶液反應而使它們褪色
D. CH3CH218OH和CH3COOH反應生成的水的相對分子質量為18
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是
A. 環戊二烯(![]() )分子中所有碳原子共平面
)分子中所有碳原子共平面
B. 正丁烷與異丁烷互為同分異構體的依據是它們的分子式相同,但分子內碳原子的連接方式不同
C. 七葉內酯(![]() )和東莨菪內酯(
)和東莨菪內酯(![]() )都是某些中草藥中的成分,它們具有相同的官能團,互為同系物
)都是某些中草藥中的成分,它們具有相同的官能團,互為同系物
D. 有機物(![]() )不能與氫氧化鈉發生中和反應,但能發生取代反應
)不能與氫氧化鈉發生中和反應,但能發生取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解精煉銅的陽極泥主要成分為Cu2Te、Ag2Se和少量金屬單質及其他化合物,工業上從其中回收碲、硒的一種工藝流程如下:
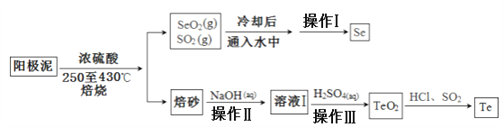
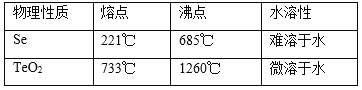
已知TeO2與Al2O3的化學性質相似,元素碲在溶液中主要以Te4+、TeO32-等形式存在;Se和TeO2的物理性質如下:
(1)加入濃硫酸焙燒前常將陽極泥中大塊顆粒先粉碎其目的是______________________。
(2)上述流程中操作僅為物理分離過程,其名稱為___________,SeO2與SO2在冷水中反應的化學方程式___________________________。
(3)焙砂中碲以TeO2形式存在,寫出氫氧化鈉溶液與TeO2反應的離子方程式___________。
(4)向溶液Ⅰ中加入硫酸時控制溶液的pH為4.5-5.0,生成TeO2沉淀。如果H2SO4過量,將導致碲的回收率_____________(填“偏高”、“偏低”或“無影響”)。
(5)將純凈的TeO2先溶于鹽酸得到四氯化碲,然后再通入二氧化硫得到碲單質,該過程中涉及到的反應類型有___________________________。
(6)上述流程中可循環利用的物質________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某一化學反應,反應物和生成物都是氣體,改變下列條件一定能使化學平衡向正反應方向移動的是( )
A.增大反應物濃度 B.減小反應容器的體積
C.增大生成物濃度 D.升高反應溫度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】非索非那定(E)可用于減輕季節性過敏鼻炎引起的癥狀。其合成路線如下
(其中R-為 )
)

(1) E中的含氧官能團名稱為___________和___________。
(2) X的分子式為C14Hl5ON,則X的結構簡式為___________。
(3) B→C的反應類型為____________________。
(4) 一定條件下,A可轉化為F( )。寫出同時滿足下列條件的F的一種同分異構體的結構簡式:_________。
)。寫出同時滿足下列條件的F的一種同分異構體的結構簡式:_________。
①能與FeCl3溶液發生顯色反應;②能使溴水褪色;③有3種不同化學環境的氫
(5)已知:![]() 。化合物G(
。化合物G( )是制備非索非那定的一種中間體。請以
)是制備非索非那定的一種中間體。請以![]() 為原料制備G,寫出相應的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)_______
為原料制備G,寫出相應的合成路線流程圖(無機試劑任用,合成路線流程圖示例見本題題干)_______
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將純鋅片和純銅片按圖方式插入同濃度的稀硫酸中一段時間,以下敘述正確的是

A. 兩燒杯中銅片表面均無氣泡產生
B. 甲中銅片是正極,乙中銅片是負極
C. 兩燒杯中溶液的pH均增大
D. 甲、乙溶液均變藍色
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com