
【題目】周期表前四周期的元素a、b、c、d、e,原子序數依次增大,a和b是組成物質種類最多的元素,c是地殼中含量最多的元素,d與b同族,e2+離子的3d軌道中有9個電子。回答下列問題:
(1)c、d兩種元素形成的化合物統稱硅石,可通過______________方法區分其結晶形和無定形的兩種存在形態,c的價電子排布圖為______________________________。
(2)A和B是生活中兩種常見的有機物,A能與CaCO3反應,可用于廚房除水垢;B分子中的碳原子數目與A中相同,可與鈉反應放出氣體。B中存在的化學鍵類型是______;
A.離子鍵 B.共價鍵 C.金屬鍵 D.氫鍵
A分子中碳原子的軌道雜化類型是___________。
(3)用“>”或“<”填空:
第一電離能 | 熔點 |
b___d | dc2晶體___d晶體 |
(4)c與e兩種元素可形成一種半導體材料,化學式為e2c,在其立方晶胞內部有四個c原子,其余c原子位于面心和頂點,則該晶胞中有____個e原子。
(5)向e2+硫酸鹽的水溶液中加入過量的氨水,可得到深藍色透明溶液,寫出生成配離子的結構______________(要求畫出配位鍵)。
【答案】X-射線衍射實驗 ![]() B sp3,sp2 > > 16
B sp3,sp2 > > 16 ![]()
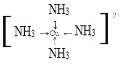
【解析】
a和b是組成物質種類最多的元素,有機物的種類最多,即a是氫元素,b是碳元素,c是地殼中含量最多的元素,是氧元素,d與b同族,即d是硅元素,e2+離子的3d軌道中有9個電子,即e的核外電子排布為:[Ar] 3dl04s1,所以e元素是銅元素。
(1) 由以上分析可得,c、d分別是氧和硅元素,他們形成的硅石,可通過X-射線衍射實驗方法區分其結晶形和無定形的兩種存在形態;氧原子的電子排布式為1s22s22p4,故價電子排布圖為![]() ;
;
(2)A和B是生活中兩種常見的有機物,A能與CaCO3反應,可用于廚房除水垢,所以A是乙酸,B分子中的碳原子數目與A中相同,可與鈉反應放出氣體,所以B是乙醇。乙醇中存在的化學鍵類型是共價鍵,B正確;
乙酸分子中有兩個碳,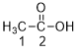 ,1號位置的碳原子的雜化類型是sp3雜化,2號位置的碳原子的雜化類型是sp2雜化;
,1號位置的碳原子的雜化類型是sp3雜化,2號位置的碳原子的雜化類型是sp2雜化;
(3)由分析可知,b是碳元素,d是硅元素,同一主族元素從上到下,第一電離能逐漸減小,所以第一電離能C> Si ; Si和SiO2都是原子晶體,原子晶體的熔沸點由原子半徑決定,原子半徑越小,共價鍵越短,熔沸點越高。O的半徑比Si小,SiO2中Si-O鍵的鍵長比Si晶體中Si-Si鍵的鍵長短,所以SiO2晶體的熔點高于Si晶體;
(4)在其立方晶胞內部有四個O原子,其余O原子位于面心和頂點,即每個晶胞中含有O原子的個數為:![]() ,由于化學式為Cu2O,故Cu原子個數為16;
,由于化學式為Cu2O,故Cu原子個數為16;
(5)NH3中的N有孤對電子,Cu2+有空軌道,可以形成配位鍵,故配離子的結構為: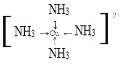 ;
;


 字詞句段篇系列答案
字詞句段篇系列答案科目:高中化學 來源: 題型:
【題目】已知A、B、C、D、E、F、G都是元素周期表中短周期主族元素,它們的原子序數依次增大。A是元素周期表中原子半徑最小的元素,D3B中陰、陽離子具有相同的電子層結構,B原子最外電子層的p能級處于半滿狀態,C原子最外層的p能級電子數是s能級電子數的2倍,C、F處于同一主族,E最外層電子數比最內層多1。回答下列問題:
(1)E元素基態原子的電子排布式為___。
(2)用電子排布圖表示F元素原子的價電子排布:____。
(3)F、G元素對應的最高價含氧酸中酸性較強的是___(填化學式)。
(4)離子半徑:D+___(填“<”“>”或“=”,下同)B3-,第一電離能:B___C,電負性:C__F。
(5)A、C形成的一種綠色氧化劑X有廣泛應用,X分子中A、C原子個數比為1∶1,X的電子式為___。試寫出Cu、稀硫酸與X反應制備硫酸銅的離子方程式:__。
(6)寫出E的單質與D的最高價氧化物對應的水化物反應的化學方程式:____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】中和滴定實驗是中學化學的重要實驗之一。下列有關說法錯誤的是![]() 滴定過程的其他操作均正確
滴定過程的其他操作均正確![]()
A.滴定管洗凈后,應用待裝液潤洗![]() 次
次
B.用![]() 酸式滴定管量取
酸式滴定管量取![]()
![]() 溶液
溶液
C.滴定接近終點時,滴定管的尖嘴可以接觸錐形瓶內壁
D.滴定前滴定管內無氣泡,終點讀數時有氣泡,所滴加液體體積偏小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用某濃度NaOH溶液滴定一元酸HA的滴定曲線如圖所示(橫坐標為滴入NaOH的體積,縱坐標為所得混合液的pH;甲基橙變色范圍為3.1~4.4)。下列判斷正確的是
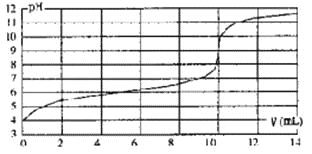
A.HA的濃度為l×10-4mol·L-1
B.實驗時可選甲基橙作指示劑
C.V=10mL,酸堿恰好中和
D.pH=7時,溶液中c(Na+)>c(A-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫和釩的相關化合物,在藥物化學及催化化學等領域應用廣泛。回答下列問題:
(1)基態釩原子的外圍電子排布式為_________________。釩有+2、+3、+4、+5等多種化合價,其中最穩定的化合價是______________,VO43-的立體構型為__________。
(2)2-巰基煙酸氧釩配合物(圖1)是副作用較小的有效調節血糖的新型藥物。
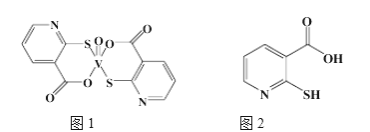
①該藥物中N原子的雜化方式是____________,其所含第二周期元素第一電離能按由大到小順序的排列是__________________。
②2-巰基煙酸(圖2)水溶性優于2-疏基煙酸氧釩配合物的原因是_________________________________。
(3)多原子分子中各原子若在同一平面,且有相互平行的p軌道,則p電子可在多個原子間運動,形成“離域π鍵”,下列物質中存在“離域π鍵”的是________。
A.SO2 B.SO42- C.H2S D.CS2
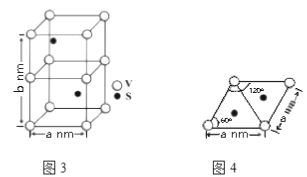
(4)某六方硫釩化合物晶體的晶胞如圖3所示,圖4為該晶胞的俯視圖,該晶胞的密度為________________ g·cm-3(列出計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環境問題已經是我國面臨的重大問題.
Ⅰ![]() 減少二氧化碳的排放是一項重要課題.研究表明,
減少二氧化碳的排放是一項重要課題.研究表明,![]() 經催化加氫可合成低碳醇:
經催化加氫可合成低碳醇:![]() 幾種化學鍵的鍵能如表所示
幾種化學鍵的鍵能如表所示
化學鍵 |
|
|
|
|
|
|
鍵能 | 803 | 436 | 332 | 409 | 463 | 326 |
通過計算得出![]() ______ .
______ .
![]() 在
在![]() 恒容密閉容器中投入
恒容密閉容器中投入![]() 和
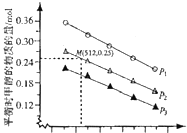
和![]() 發生該反應,實驗測得不同溫度及壓強下,平衡時甲醉的物質的量如圖所示.
發生該反應,實驗測得不同溫度及壓強下,平衡時甲醉的物質的量如圖所示.
當壓強為![]() ,溫度為512K時,向該容器中投入
,溫度為512K時,向該容器中投入![]() 、
、![]()
![]() 、2mol
、2mol![]() 、
、![]()
![]() 時,平衡向 ______ 方向移動.
時,平衡向 ______ 方向移動.
![]() 以
以![]() 、空氣
、空氣![]() 含量
含量![]() 、KOH溶液為原料,以石墨為電極可直接構成燃料電池,則該電池的負極反應式為 ______ ;用該電池電解
、KOH溶液為原料,以石墨為電極可直接構成燃料電池,則該電池的負極反應式為 ______ ;用該電池電解![]()
![]() 溶液,當燃料電池消耗標況下56L空氣時,計算理論上兩極電解產生氣體的總物質的量 ______ .
溶液,當燃料電池消耗標況下56L空氣時,計算理論上兩極電解產生氣體的總物質的量 ______ .
Ⅱ![]() 也是一種大氣污染物,可以用海水處理含
也是一種大氣污染物,可以用海水處理含![]() 的廢氣,海水中主要離子的含量如下:
的廢氣,海水中主要離子的含量如下:
成分 | 含量 | 成分 | 含量 |
| 18980 |
| 400 |
| 10560 |
| 142 |
| 2560 |
| 1272 |
![]() 海水經初步處理后,還含有
海水經初步處理后,還含有![]() 、
、![]() ,
,![]() 、
、![]() ,向其中加入石灰漿使海水中的
,向其中加入石灰漿使海水中的![]() 轉換為
轉換為![]() ,當
,當![]() 剛好沉淀完全時,
剛好沉淀完全時,![]()
![]() 為 ______
為 ______ ![]()
已知![]()
![]()
![]() 處理過的廢氣中
處理過的廢氣中![]() 的含量可以通過碘量法來測定.用到的試劑有:
的含量可以通過碘量法來測定.用到的試劑有:![]() 的碘標準溶液,淀粉溶液.當把處理后的廢氣以每分鐘
的碘標準溶液,淀粉溶液.當把處理后的廢氣以每分鐘![]() 標況下
標況下![]() 的流速通入到100mL含有淀粉的碘標準液中,tmin達到滴定終點.滴定終點的現象為 ______ 計算該處理氣中
的流速通入到100mL含有淀粉的碘標準液中,tmin達到滴定終點.滴定終點的現象為 ______ 計算該處理氣中![]() 的含量 ______
的含量 ______ ![]() 用含a,t的式子表示
用含a,t的式子表示![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若往![]() 的弱酸
的弱酸![]() 溶液中逐滴加入一定濃度的燒堿溶液,測得混合溶液的溫度變化如圖所示,下列有關說法正確的是______
溶液中逐滴加入一定濃度的燒堿溶液,測得混合溶液的溫度變化如圖所示,下列有關說法正確的是______![]() 填序號
填序號![]() 。
。
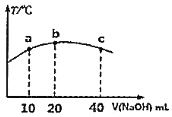
![]() 該燒堿溶液的濃度為
該燒堿溶液的濃度為![]()
![]() 該燒堿溶液的濃度為
該燒堿溶液的濃度為![]()
![]() 的電離平衡常數:b點
的電離平衡常數:b點![]() 點
點
![]() 從b點到c點,混合溶液中一直存在:
從b點到c點,混合溶液中一直存在:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)把0.4 mol X氣體和0.6 mol Y氣體混合于2 L密閉容器中,使它們發生如下反應:4 X(g)+5 Y(g) ![]() n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若測知以Z的濃度變化表示的反應速率為0.05 mol·(L·min)-1,計算:前2 min內用X的濃度變化表示的平均反應速率________化學反應方程式中n的值是______________________,2 min末時Y的濃度_____________________。
n Z(g)+6 W(g)。2 min 末已生成0.3 mol W,若測知以Z的濃度變化表示的反應速率為0.05 mol·(L·min)-1,計算:前2 min內用X的濃度變化表示的平均反應速率________化學反應方程式中n的值是______________________,2 min末時Y的濃度_____________________。
(2)已知有機物 HT 能將 Ce3+從水溶液中萃取出來,該過程可表示為:2Ce3+ (水層)+ 6HT(有機層)![]() 2CeT3 (有機層)+ 6H+(水層) 從平衡角度解釋:向 CeT3 (有機層)加入 H2SO4 獲得較純的含 Ce3+的水溶液的原因是__________________________________。
2CeT3 (有機層)+ 6H+(水層) 從平衡角度解釋:向 CeT3 (有機層)加入 H2SO4 獲得較純的含 Ce3+的水溶液的原因是__________________________________。
(3)硫酸鐵銨礬[Fe2(SO4) 3·(NH4) 2SO4·24H2O]廣泛用于水的凈化處理,其凈水原理用離子方程式解釋是______________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向濃度均為 0.1mol·L1、體積均為100mL的兩種一元酸HA、HB的溶液中,分別加入固體NaOH,溶液中的lg![]() 隨加入 NaOH 的物質的量的變化如圖所示。下列說法正確的是
隨加入 NaOH 的物質的量的變化如圖所示。下列說法正確的是

A.由水電離出的 c(H+)的順序為:c﹥a﹥b
B.b 點時酸堿恰好完全中和
C.c 點溶液中:c(B)﹥c(HB)
D.常溫下電離常數:HA﹤HB
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com