
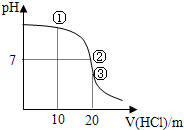
| A. | ①溶液:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | ②溶液:c(NH4+)=c(Cl-)=c(OH-)=c(H)+ | |
| C. | ③溶液:含有的微粒數為5種 | |
| D. | 滴定過程中可能出現:c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
分析 A、用10mL0.1000mol/L鹽酸和20.00mL0.1000mol/LNH3•H2O溶液反應,得到的是氯化銨和氨水的混合物;
B、②溶液顯示中性,根據溶液中的電荷守恒來計算回答;
C、20mL0.1000mol/L鹽酸和20.00mL0.1000mol/LNH3•H2O溶液反應,得到的是氯化銨溶液;
D、滴定過程中可能出現鹽酸相對于氨水過量、不足、恰好反應等情況,據此回答判斷.
解答 解:A、用10mL0.1000mol/L鹽酸和20.00mL0.1000mol/LNH3•H2O溶液反應,得到的是氯化銨和氨水的混合物,溶液顯示堿性,c(NH4+)>c(Cl-)>c(OH-)>c(H+),故A錯誤;
B、②溶液顯示中性,根據溶液中的電荷守恒,得到:c(NH4+)=c(Cl-)>c(OH-)=c(H)+,故B錯誤;
C、③是20mL0.1000mol/L鹽酸和20.00mL0.1000mol/LNH3•H2O溶液反應,得到的是氯化銨溶液,含有的微粒數為4種:銨根離子、氯離子、氫離子、氫氧根離子,故C錯誤;
D、滴定過程中可能出現鹽酸相對于氨水過量、不足、恰好反應等情況,存在c(NH4+)>c(OH-)>c(Cl-)>c(H+),可以是剩余大量的氨水以及生成少量的氯化銨時的情況,故D正確.
故選D.
點評 本題考查學生酸堿之間的反應情況以及溶液中離子濃度的大小關系比較知識,屬于綜合知識的考查,難度中等.


科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 兩極材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | 硫酸溶液 | 硝酸銀溶液 | 蔗糖溶液 | 稀鹽酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
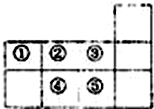
| A. | 元素①于第二周期第IVA族 | B. | 氣態氫化物的穩定性:④>② | ||
| C. | 單質⑤遇足量元素①的氫化物有白煙 | D. | 元素的最高正化合價:③=⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
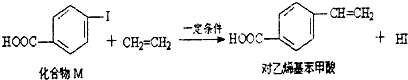
| A. | 對乙烯基苯甲酸的分子式為C9H10O2 | |
| B. | 對乙烯基苯甲酸的同分異構體共有三種 | |
| C. | 對乙烯基苯甲酸即屬于羧酸,又屬于烯烴 | |
| D. | 二者均可發生取代反應和聚合反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖是某空間站能量轉化系統的局部示意圖,其中燃料電池采用KOH為電解液,下列有關說法中不正確的是( )
如圖是某空間站能量轉化系統的局部示意圖,其中燃料電池采用KOH為電解液,下列有關說法中不正確的是( )| A. | 該能量轉化系統中的水也是可能循環的 | |
| B. | 燃料電池系統產生的能量實際上來自于水 | |
| C. | 水電解系統中的陽極反應:4OH--4e-=2H2O+O2↑ | |
| D. | 燃料電池放電時的正極反應:O2+4e-+2H2O=4OH - |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .
.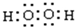 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| X | Y | ||
| Z | W |
| A. | 原子半徑由小到大的順序為X<Y<Z<W | |
| B. | Y元素最高價氧化物對應的水化物化學式為H3YO4 | |
| C. | X、Z兩種元素的氧化物中所含化學鍵類型相同 | |
| D. | Y最簡單氣態氫化物比Y相鄰周期同主族元素氣態氫化物更加穩定 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com